Eine antitumorale Therapie geht häufig mit Nebenwirkungen und Organtoxizitäten einher, die insbesondere Pflegende besonders fordern. Von Fatigue oder Übelkeit und Erbrechen bis zu speziellen Nebenwirkungen bei immunonkologischen Therapien: Das gesamte Spektrum typischer Nebenwirkungen und Organtoxizitäten sowie möglicher therapeutischer Maßnahmen wird hier mit besonderem Blick auf die Praxis dargestellt.
Nebenwirkungen/Organtoxizitäten und pflegerische Maßnahmen
Norbert Schleucher, Alexandra Kammerer, Mirko Laux, Ulrike Ritterbusch, Daniel Wecht, Rolf Bäumer, Sabine Gärtner, Andrea Maiwald, Rita Bodenmüller-Kroll
Für einige der im nachfolgenden gesamten Teil aufgeführten Nebenwirkungen/Organtoxizitäten sind – über die allgemeinen Aufgaben der Pflegekräfte hinaus – keine speziellen pflegerischen Maßnahmen zu nennen.
1 Fatigue (tumorbedingt)
Karl Reif
Tumorbedingte Fatigue ist ein quälendes anhaltendes subjektives Gefühl von körperlicher, emotionaler oder kognitiver Müdigkeit oder Erschöpfung, das in Zusammenhang mit Krebs oder einer Krebstherapie auftritt, ohne angemessenen Bezug zu vorherigen Aktivitäten, und die Alltagsfunktionalität beeinträchtigt. Wir unterscheiden akute und chronische Fatigue:
Akute Fatigue tritt während der Krebsbehandlung auf und ist als Folge des Krankheitsgeschehens und der erwünschten wie auch unerwünschten Wirkungen der Tumortherapie anzusehen. In vielen Fällen bildet sich die akute Fatigue innerhalb von drei Monaten nach Abschluss der Krebstherapie von selbst zurück.
Chronische Fatigue kann dagegen über Monate oder sogar Jahre nach Therapieabschluss anhalten.
Fatigue ist eines der häufigsten Symptome, die im Zusammenhang mit einer Krebserkrankung auftreten. Bei Patienten, die eine zytostatische Chemotherapie, Strahlentherapie, Knochenmark- bzw. Stammzelltransplantation oder eine Behandlung mit Immunmodulatoren erhalten, tritt Fatigue bei fast allen auf. In einer groß angelegten Befragung von über 1500 Krebspatienten mit verschiedenen Tumorarten litten 8 von 10 Patienten mit Chemo- und/oder Strahlentherapie unter Fatigue [1].
Bei Patienten mit Fatigue können klinisch verschiedene Verläufe beobachtet werden:
- allmähliche Steigerung im Verlauf der Behandlung bis zum Therapieende
- Schwankungen des Fatigue-Schweregrads, z. B. Zunahme während des Therapiezyklus und Abnahme zwischen den Zyklen
- etwa gleichbleibender Schweregrad von Beginn bis Ende der Therapie
Bei fast der Hälfte aller Patienten mit einer akuten Fatigue wird Fatigue chronisch und kann über Jahre unverändert bestehen bleiben.
1.1 Ursache
Welche Faktoren Fatigue auslösen oder verschlimmern können, ist bis heute nicht vollkommen bekannt. Im Allgemeinen wird davon ausgegangen, dass sowohl physiologische als auch psychosoziale Ursachen an der Entstehung von Fatigue beteiligt sind. Spezifische Einzelursachen sind nicht bekannt. Als Auslöser werden immunologische, endokrine, neurologische, hämatologische, muskuloskelettale und Ernährungsfaktoren diskutiert. Zudem weisen psychische Faktoren wie Depression und Angst einen engen Zusammenhang zu Fatigue auf; auch der Einfluss von Schlaf, Schmerzen und körperlicher Inaktivität wurde beschrieben. Die Tumorlokalisation spielt ebenfalls eine Rolle, jedoch scheinen die Behandlungsintensität bzw. Therapieschemata nur einen geringeren Einfluss zu haben.
1.2 Symptome
Fatigue kann sich beim einzelnen Patienten in sehr unterschiedlicher Weise zeigen: Körperliche, kognitive und emotionale Symptome können in verschiedener Stärke und Kombination das Bild beherrschen. Körperliche Fatigue zeigt sich in reduzierter Leistungsfähigkeit, Schwäche, Kraftlosigkeit, einem vermehrten Schlafbedürfnis und einem vermehrten Müdigkeitsgefühl. Unter kognitiver Fatigue werden Konzentrations- und Aufmerksamkeitsstörungen sowie Schlafstörungen gefasst. Emotionale Fatigue ist durch Antriebslosigkeit und Motivationsverlust, Hoffnungs- und Ratlosigkeit, Depression und Angst gekennzeichnet.
Patienten erleben Fatigue als belastender als andere Symptome, die mit der Tumorerkrankung oder Therapie einhergehen, wie etwa Schmerzen, Übelkeit und Erbrechen. Bei Gesunden tritt Erschöpfung nach erfolgter körperlicher oder kognitiver Anstrengung auf und die Erholung findet durch Ausruhen und Schlaf statt; von Fatigue betroffene Patienten erfahren jedoch eine Erschöpfung, die unabhängig von vorheriger Anstrengung auftritt und durch Ausruhen und Schlaf kaum beeinflusst werden kann.
1.3 Diagnostik
Zum Screening und Assessment der tumorbedingten Fatigue werden international verbreitete Skalen (VAS = visuelle Analogskala; NRS = numerische Analogskala) und multidimensionale Fragebögen sowie klinische Interviews verwendet. Skalen kommen vor allem zum Screening sowie zur Verlaufskontrolle der Fatigue zum Einsatz.
Dafür reicht die einfache Frage: „Wie schätzen Sie Ihre Fatigue in den letzten sieben Tagen auf einer Skala von 0–10 ein?“ Nach Empfehlungen des National Comprehensive Cancer Network (NCCN) (USA) wird die Intensität der Fatigue in keine oder leichte Fatigue (0–3), mittelgradige (4–6) und schwere Fatigue (7–10) eingestuft.
Nach der Schweregradeinteilung von Fatigue gemäß den Common Terminology Criteria for Adverse Events (NCI-CTCAE), Version 5.0 (2017) des US-amerikanischen National Cancer Institute (NCI) werden drei Grade unterschieden:
| Grad | Beschreibung |
| 1 | Fatigue, die durch Ausruhen gelindert werden kann. |
| 2 | Fatigue, die durch Ausruhen nicht gelindert werden kann; instrumentelle Aktivitäten des täglichen Lebens (IADL) beeinträchtigt. |
| 3 | Fatigue, die durch Ausruhen nicht gelindert werden kann; Selbstpflegeaktivitäten des täglichen Lebens (ADL) beeinträchtigt. |
| Definition: Eine Störung, gekennzeichnet durch einen Zustand allgemeiner Schwäche mit betonter Unfähigkeit, genügend Energie für die Verrichtungen des täglichen Lebens zu sammeln. Die NCI-CTCAE-Grade 3 und 4 kommen bei Fatigue nicht vor. | |
Zu den instrumentellen Aktivitäten des täglichen Lebens (IADL) zählt das National Cancer Institute die Zubereitung von Mahlzeiten, das Einkaufen von Lebensmitteln und Kleidung, die Benutzung des Telefons, den Umgang mit Geld u. a. Unter Selbstpflegetätigkeit des täglichen Lebens (ADL) werden baden, an- und auskleiden, essen, die Toilette benutzen und Medikamente einnehmen gefasst. Es wird dabei vorausgesetzt, dass der Patient nicht bettlägerig ist.
Um die ganze Komplexität der Fatigue zu erfassen, kommen wissenschaftlich entwickelte Fragebögen zum Einsatz. Beispielsweise entwickelt und erprobt derzeit die European Organisation for Research and Treatment of Cancer (EORTC) einen Fragebogen zur Fatigue, der anschließend in alle europäischen Sprachen übersetzt werden soll. Bereits jetzt einsetzbar ist der in der Schweiz entwickelte deutschsprachige Fragebogen Fatigue Assessment Questionnaire (FAQ) [2].
Weitere Fragebögen, die zur Erfassung der Fatigue routinemäßig eingesetzt werden, sind:
| Name | Beschreibung |
| EORTC QLQ-C30 [3] | Fragebogen zur Erfassung der Lebensqualität von Krebspatienten; eindimensionale Erfassung, 3 Items; Dimension: körperliche Fatigue |
| FACIT-Fatigue, Functional Assessment of Chronic Illness Therapy-Fatigue [4] | Fragebogen zur Erfassung von Fatigue bei chronisch Kranken; eindimensionale Erfassung, 13 Items; Dimension: körperliche Fatigue |
| Multidimensional Fatigue Inventory (MFI) | Fragebogen zur Erfassung von Fatigue; keine Beschränkung auf Krebspatienten; mehrdimensionale Erfassung, 20 Items; erfasst werden die Dimensionen allgemeine, physische, mentale Fatigue, Motivation und Aktivität |
Jedoch können auch im klinischen Patientengespräch sehr gut die Ausprägungen, Verläufe und Folgen der Fatigue erfragt und erfasst werden.
Depression und Angst gehören zu den häufigsten psychischen Problemen, die bei Krebspatienten auftreten können. Kardinalsymptome der Depression sind depressive Verstimmung, Verlust an Interesse und Freude, Gefühle von Wertlosigkeit und Gedanken an den Tod bzw. Suizidgedanken. Die differenzialdiagnostische Abgrenzung von Fatigue zu Depression fällt häufig schwer; sie unterliegt fließenden Übergängen und bedarf einer genauen Anamnese, Diagnostik und Verlaufsbeobachtung. Bei Verdacht auf eine Depression sollte ein Psychoonkologe zu Rate gezogen werden. Erste Hinweise auf das Vorliegen einer Depression können depressive Verstimmungen, die bereits vor der Krebserkrankung aufgetreten sind, Sich-wertlos-Fühlen und Suizidgedanken sein.
Im Rahmen der Diagnostik müssen klinische Störungen wie z. B. Tumor-, Muskel-, Gelenks- und Knochenerkrankungen sowie Hyper- oder Hypotonie und auch eine eventuell bestehende Schilddrüsenunterfunktion von der Fatigue-Symptomatik abgegrenzt werden.
1.4 Interventionen
In der einzigen internationalen Leitlinie zur tumorbedingten Fatigue [5], herausgegeben vom National Comprehensive Cancer Network (NCCN), USA, werden eine Reihe von Interventionen empfohlen, für die sich in Studien Wirkungen gezeigt haben, wenn auch die Effekte oftmals nur klein waren: Beratung, allgemeine Strategien (energieerhaltende Maßnahmen, Ablenkung u. a.), nicht medikamentöse Maßnahmen (Steigerung der körperlichen Aktivität, Erholung, Ernährungsberatung, Schlafhygiene, Förderung familiärer Interaktion, psychosoziale Interventionen) und medikamentöse Therapie.
1.5 Steigerung der körperlichen Aktivität
Die Steigerung der körperlichen Aktivität in Form von moderatem Ausdauersport oder angepasstem Krafttraining ist von allen Interventionen diejenige, die am besten wissenschaftlich untersucht wurde, und die die besten Wirkungen zeigt. Die Veröffentlichungen decken das gesamte Feld der Tumorerkrankungen ab und es zeigen sich Wirksamkeiten in allen Krankheitsstadien und allen Tumorentitäten, wenngleich, wie so oft, Brustkrebspatientinnen am häufigsten untersucht wurden.
Bewegungsübungen zeigen während der Krebstherapie eine höhere Effektivität als nach Therapieabschluss; Gruppenprogramme waren zudem effektiver als Einzelmaßnahmen. Unklar ist jedoch noch immer die Dosis-Wirkungs-Beziehung, d. h. welche Dosis Bewegung zur besten Wirkung führt. Ein entscheidender Grundsatz bei Bewegungsinterventionen ist, dass stets das individuelle, tagesaktuelle Leistungsniveau und eventuelle Kontraindikationen berücksichtigt werden sollten. Zudem sollten Bewegungsinterventionen sowohl Kraft- als auch Ausdauerübungen (sog. multimodale Übungen) einschließen und bereits frühzeitig während der Krebstherapie beginnen.
1.6 Therapeutische Maßnahmen/Medikamente
Erythropoetin, Psychostimulanzien, Antidepressiva und Steroide sind diejenigen Medikamentengruppen, die am häufigsten auf ihre Wirksamkeit hinsichtlich Fatigue untersucht wurden.
Erythropoetin regt die Blutbildung an und wird bei Anämie verordnet. Bei einem Hb-Wert von 8 bis 10 g/dl zeigt Erythropoetin in Studien auch eine Wirksamkeit hinsichtlich Fatigue, jedoch ist eine Anämie nur selten der alleinige Auslöser für Fatigue [6]. Zudem gab 2008 das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) eine Risikoinformation über Epoetine heraus, da in großen Übersichtsarbeiten unter der Behandlung mit Epoetinen eine erhöhte Sterblichkeit bzw. ein verkürztes progressionsfreies Intervall festgestellt wurden. Seither ist die Indikationsstellung für Erythropoetin und ähnliche Medikamente stark eingeschränkt worden.
Methylphenidat, das zur Gruppe der Psychostimulanzien gehört, zeigte in Studien geringe Verbesserungen der Fatigue [6]. Der Wirkstoff wird vor allem bei Aufmerksamkeitsdefizit-/Hyperaktivitätsstörungen verordnet. Er unterliegt in Deutschland betäubungsmittelrechtlichen Vorschriften und ist nicht für die Behandlung der Fatigue zugelassen. Steroide und Antidepressiva hatten in Studien keine Effekte auf Fatigue.
Eine etablierte Arzneimitteltherapie zur Behandlung der tumorbedingten Fatigue besteht somit zurzeit nicht.
1.7 Pflegeinterventionen
Alle Tumorpatienten sollen laut internationaler Leitlinie des NCCN beim ersten Kontakt nach Fatigue gefragt werden. Im weiteren Verlauf der Therapie sowie nach Therapieabschluss sollten die Patienten ebenfalls regelmäßig einem Fatigue-Screening unterworfen werden. Hierbei wird lediglich nach dem Schweregrad auf einer Skala von 0 bis 10 gefragt.
Wird keine (0) oder eine leichte Fatigue (1–3) angegeben, ist es ausreichend, die Patienten über Fatigue zu informieren und hinsichtlich allgemeiner Strategien zum Umgang mit Fatigue zu beraten. Bei der Information über Fatigue sollte betont werden, dass eine Verschlimmerung während der Therapie sehr wahrscheinlich ist und dass tumorbedingte Fatigue nicht etwa ein Zeichen dafür ist, dass die Therapie nicht wirkt oder die Erkrankung ungünstig verläuft.
Unter allgemeinen Strategien werden Möglichkeiten der energiesparenden Alltagsgestaltung (z. B. ein Stuhl auf dem Treppenabsatz), Tagesstrukturierung (z. B. anstrengende Aktivitäten in Zeiten mit viel Energie legen), die Priorisierung und Delegation von Aufgaben sowie Methoden der aktiven Entspannung (wie z. B. die Progressive Muskelrelaxation) verstanden. Diese Maßnahmen können Patienten nach einer pflegerischen Beratung selbstständig durchführen. Sie helfen vor allem dabei, mit der vorhandenen Erschöpfung besser umgehen zu können.
Wird im Screening vom Patienten ein Schweregrad von 4 bis 10 angegeben (mittelschwere bis schwere Fatigue), so ist zunächst eine eingehende Anamnese erforderlich. Diese sollte Fragen nach dem Verlauf der Fatigue, nach Auslösern und möglichen verstärkenden Faktoren enthalten. Zudem sollten die Auswirkungen auf das Alltagsleben der Patienten erfragt werden. Fragen nach möglichen Ressourcen wie zum Beispiel sozialer Unterstützung oder früheren positiven Erfahrungen im Umgang mit Fatigue ergänzen die Anamnese. Anschließend sollen Faktoren, die zur Fatigueentstehung oder zur Verschlimmerung beitragen können, aber in der Regel gut therapierbar sind, erfasst und medizinisch oder psychologisch behandelt werden. Zu diesen zählen Nebenwirkungen von Medikamenten, Schmerzen, Depression, Anämie, Schlafstörungen, Mangel- oder Fehlernährung.
Da bewegungsfördernde Maßnahmen eine hohe Wirksamkeit haben, sollten die Patienten mit mittelgradiger bis schwerer Fatigue zu einem individuell und tagesaktuell angepassten Bewegungsprogramm angeleitet und beraten werden. Hierbei sollten insbesondere während der Tumortherapie mögliche Kontraindikationen, wie etwa Knochenmetastasen, Thrombozytopenie, Anämie, Fieber bzw. eine akute Infektion berücksichtigt werden. Bieten die Klinik oder andere Einrichtungen bereits strukturierte und möglichst evaluierte spezielle Bewegungsprogramme an, sollten Patienten dazu beraten werden, daran teilzunehmen. Ansonsten können mit den Patienten individuelle Bewegungsprogramme abgestimmt werden. Wichtig ist dabei, dass sich die Patienten weder überfordern noch unterfordern: Im ersten Fall wird dies höchstwahrscheinlich negative Auswirkungen auf das Allgemeinbefinden haben, im zweiten Fall bleibt voraussichtlich der Therapieerfolg aus. Diese Balance zu finden ist jedoch nicht einfach und es ist sicherer, wenn sich Patienten zunächst unterfordern und die Bewegungsintensität sehr langsam steigern, ohne sich zu überfordern.
Viele Krebspatienten leiden zudem unter Schlafstörungen. Diese können Fatigue auslösen oder verstärken, daher sollten allgemeine Maßnahmen zur Schlafhygiene durchgeführt werden. Sind diese wirkungslos, können eine psychologische Verhaltenstherapie oder vorübergehend schlaffördernde Arzneimittel hilfreich sein.
Je nach individueller Situation der Patienten können weitere Interventionen wie Entspannungsmaßnahmen, Massage, von ausgebildeten Psychotherapeuten durchgeführte kognitive Verhaltenstherapie oder unterstützende Gruppenangebote in Erwägung gezogen werden. Eine Unterstützung bei der Krankheitsbewältigung, die Identifizierung und Aktivierung von individuellen Ressourcen der Patienten sowie eine Stärkung des Selbsthilfepotenzials sind grundsätzlich sinnvolle pflegerische Aktivitäten, die auch bei der Bewältigung der Fatigue hilfreich sein können.
Seit Kurzem steht in Deutschland für Krebspatienten nach Therapieabschluss ein wissenschaftlich entwickeltes Selbstmanagementprogramm zur Verfügung. Die Wirksamkeit dieses Programms wurde in einer groß angelegten Studie nachgewiesen. In dieses Programm wurden die wichtigsten oben genannten hilfreichen Interventionen integriert [7].
Literatur
- Henry DH, Viswanathan HN, Elkin EP, Traina S, Wade S, Cella D (2008) Symptoms and treatment burden associated with cancer treatment: results from a cross-sectional national survey in the U.S. Support Care Cancer 16: 791–801
- Glaus A (2001) Messung der Müdigkeit bei Krebskranken im deutschen Sprachraum: Die Entwicklung des Fatigue Assessment Questionnaires. Pflege 14(3): 161–170
- https://qol.eortc.org/qlg-funded-projects/ (aufgerufen am 17.04.2024)
- www.facit.org/FACITOrg/Questionnaires (aufgerufen am 5.3.2021)
- National Comprehensive Cancer Network (2012) Cancer-Related Fatigue. Online unter www.nccn.org/ (englischsprachige, sehr empfehlenswerte Leitlinie) (aufgerufen am 5.3.2021)
- Minton O, Richardson A, Sharpe M, Hotopf M, Stone P (2010) Drug therapy for the management of cancer-related fatigue. Cochrane Database Syst Rev 2010 Jul 7(7): CD006704
- De Vries U, Reif K, Petermann F, Görres S (2012) Fatigue individuell bewältigen (FIBS). Schulungsmanual und Selbstmanagementprogramm für Menschen mit Krebs. Huber, Bern
Weiterführende Literatur
Reif K (2012) Tumorbedingte Fatigue. Forum Onkologische Pflege 1: 32–41
https://www.krebsinformationsdienst.de/leben/fatigue/fatigue-index.php (aufgerufen am 17.04.2024)
https://www.krebsinformationsdienst.de/service/broschueren/fatigue.php (aufgerufen am 17.04.2024)
2 Gastrointestinale Toxizität
Der Gastrointestinaltrakt (GIT) beginnt in der Mundhöhle (Cavum oris) und endet am Ausgang des Mastdarmes (Anus). Zu den Organen des GIT zählen die Mundhöhle, der Ösophagus, der Magen, das Duodenum, das Jejunum sowie das Ileum und das Kolon. Physiologischerweise sind alle diese Organe mit einem spezialisierten Oberflächenepithel ausgekleidet.
2.1 Ursache
Die Zellen des Oberflächenepithels gehören zu den Zellen mit hohem Proliferationsindex und werden aus diesem Grunde bei zytostatischer Behandlung bevorzugt geschädigt. Dem liegt als direkt toxischer Mechanismus zugrunde, dass Zytostatika vermehrt in schnell proliferierende Zellen aufgenommen werden. Es kommt so auch zum Zelltod der Zellen in der Basalschicht, die für die Epithelregeneration verantwortlich sind. Deutlich seltener führen z. B. irritativ toxische Mechanismen oder die G-Protein-induzierte Aktivierung der sogenannten Cyclo-AMP-Kaskade zur Induktion einer Diarrhö.
In erster Linie sind dabei die applizierten Zytostatika für die Nebenwirkung verantwortlich, jedoch können auch zur supportiven Therapie eingesetzte Medikamente, insbesondere Antiemetika vom Typ der Serotonin-Antagonisten (5-Hydroxytryptophan-3-Antagonisten, z. B. Ondansetron, Granisetron) zu den Nebenwirkungen (Obstipation) beitragen.
2.2 Symptome
Die Nebenwirkungen auf den GIT können dabei mannigfaltig sein, so können Stomatitiden, Ösophagitiden und Gastritiden auftreten, ebenso wie schwergradige Diarrhöen als Ausdruck einer epithelialen Schädigung im Dünn- oder Dickdarm. Allerdings kann die gastrointestinale Toxizität auch in Form einer Obstipation auftreten.
2.3 Diarrhö durch zytostatische Chemotherapie oder Tyrosinkinase-Inhibitoren
2.3.1 Ursache
Im Rahmen der Zytostatikatherapie, bei der neben dem Tumorgewebe auch diejenigen gesunden Gewebe angegriffen werden, die einer schnellen Zellteilung unterliegen, kann es zu Veränderungen der gastrointestinalen Schleimhaut kommen, die in sämtlichen Darmabschnitten betroffen sein kann. So kann es zu Ileitis, Kolitis und Proktitis mit Diarrhö kommen. Zu den am häufigsten eine Diarrhö auslösenden Zytostatika gehören Methotrexat, 5-Fluorouracil, Anthrazykline, Bleomycin und Actinomycin D. Daneben können auch zahlreiche Tyrosinkinase Inhibitoren zu Durchfällen führen.
2.3.2 Symptome
Unter einer Diarrhö versteht man das Auftreten von mehr als drei Stuhlgängen täglich, wobei die Konsistenz dieser Stühle wässrig oder breiig ist. Der Diarrhö kann sowohl eine Schädigung des Dünndarmes als auch des Dickdarmes oder die Kombination von beidem zugrunde liegen. Dabei findet sich klinisch bei einer Dickdarmdiarrhö ein dünnflüssiger Stuhlgang mit Beimengungen von Schleim oder Blut, während bei isolierter Dünndarmdiarrhö keine Beimengungen zum Stuhl nachzuweisen sind. Beide Diarrhö-Typen sind von einem ausgeprägt unangenehmen Geruch begleitet, der durch die Abschilferung nekrotischer Darmepithelien als Folge der zytostatischen Schädigung entsteht. Klinisch relevant sind die eintretenden Flüssigkeitsverluste, sodass bei ausgeprägten Formen Alterationen des Kreislaufsystems mit Hypotonie und Tachykardie zu befürchten sind. Eine weitere Komplikation ist das Übertreten von Darmbakterien durch die geschädigte Mukosa in die Blutbahn mit Auslösung eines septischen Krankheitsbildes oder der Übertritt in das Peritoneum mit der Folge einer septischen Durchwanderungsperitonitis.
Nach der Schweregradeinteilung von Durchfall gemäß den Common Terminology Criteria for Adverse Events (NCI-CTCAE), Version 5.0 (2017), des US-amerikanischen National Cancer Institute (NCI) werden fünf Grade unterschieden:
| Grad | Beschreibung |
| Grad 1 | Erhöhung <4 Stühle pro Tag über Normalfrequenz; geringer Anstieg der Stomaforderung über die Normalmenge hinaus |
| Grad 2 | Erhöhung 4–6 Stühle pro Tag über die Normalfrequenz hinaus; mäßiger Anstieg der Stomaforderung über die Normalmenge hinaus |
| Grad 3 | Erhöhung >= 7 Stühle pro Tag über die Normalfrequenz hinaus; Inkontinenz; Krankenhauseinweisung angezeigt; schwerwiegender Anstieg der Stomaforderung über die Normalmenge hinaus; Einschränkung der selbstversorgenden ATL |
| Grad 4 | Lebensbedrohliche Folgen; Intervention dringlich angezeigt |
| Grad 5 | Tod |
| Definition: Eine Störung, gekennzeichnet durch häufige und wässrige Stuhlentleerungen | |
Neben dieser Gradeinteilung gelten als komplizierte Diarrhöen Durchfälle, die mit abdominellen Krämpfen, Übelkeit oder Erbrechen ≥ Grad 2 (nach NCI-CTCAE), einer Verschlechterung des Allgemeinzustandes, Blutbeimengungen, Dehydratation, Neutropenie oder Fieber einhergehen!
Gemeinsame Probleme aller Diarrhö-Formen sind, neben der subjektiven Belästigung des Patienten, der Verlust von Flüssigkeit, Elektrolyten und Proteinen sowie eine insgesamt unzureichende Kalorien- und Flüssigkeitszufuhr. Der Verlust von Wasser stellt sich beim Patienten subjektiv in Durst, Müdigkeit und Schwäche dar. Natriumverlust führt zu Wadenkrämpfen, Kopfschmerzen und Bewusstseinsstörungen. Kaliumverlust zu Muskelschwächen. Der Verlust von Kohlenhydraten und Proteinen führt zur Schwäche beim Patienten und zur Verstärkung des Krankheitsgefühls, daraus resultieren Gewichtsabnahme und Zeichen des katabolischen Stoffwechsels.
2.3.3 Diagnostik
Die klinische Diagnostik umfasst insbesondere das Einsenden mehrerer Stuhlproben zur mikrobiologischen Diagnostik. Eine Rektoskopie mit Asservation von Schleimhautmaterial zur mikrobiologischen Diagnostik ist jedoch in den seltensten Fällen erforderlich. Auch zur Diagnose einer pseudomembranösen Kolitis (siehe unten) ist die Rektoskopie nicht erforderlich.
2.3.4 Therapeutische Interventionen
Therapeutische Basismaßnahme ist die intravenöse Rehydratation mit Ausgleich entstandener Elektrolytverluste, um Hypokaliämien mit der Gefahr eines Kammerflimmerns zu vermeiden. Der Flüssigkeitsausgleich darf dabei nur durch sogenannte Vollelektrolytlösungen (Ringer-Lösung oder Kochsalzlösung) erfolgen, nicht jedoch durch Glukoselösungen! Medikamentös dominiert bei Diarrhöen die Gabe von Loperamid (Imodium®, Lopedium® etc.). In ausgeprägten Fällen werden dabei 4 mg (zwei Kapseln) alle 2 Stunden verabreicht. Loperamid steht auch in sublingual applizierbarer Form zur Verfügung. Sollte diese Behandlung nicht ausreichend sein, können als Ultima ratio Opiatverbindungen angewendet werden (z. B. Tinctura opii). Neben der motilitätshemmenden Therapie steht die subkutane Anwendung von Octreotid (Sandostatin®) zur Verfügung, wobei Octreotid insbesondere bei sekretorischer Diarrhö angewendet wird. Auch Budesonid, welches sonst zur Behandlung chronisch entzündlicher Darmerkrankungen verwendet wird, kann als Reservemittel eingesetzt werden. In klinischen Studien wurde die Wirksamkeit von Budesonid zur Behandlung der Irinotecan und 5-FU assoziierten Diarrhö nachgewiesen.
Prinzipiell handelt es sich bei Diarrhöen um gut kupierbare Krankheitsbilder; insbesondere ältere Patienten mit höhergradigen Diarrhöen können jedoch vital gefährdet sein. Diarrhöen, die länger als 48 Stunden bestehen, sollten antibiotisch behandelt werden. Dazu eignen sich insbesondere Gyrasehemmer, wie Ciprofloxacin. Bei jeder länger als 72 Stunden bestehenden Diarrhö sollte der Patient zudem hospitalisiert und überwacht werden!
Neben der zytostatischen Chemotherapie kann auch die supportive Therapie mit Antibiotika (insbesondere Betalaktam-Antibiotika wie Penicilline) eine Diarrhö induzieren. Dabei kommt es pathophysiologisch durch die Antibiotika zu einer Schädigung von Darmbakterien mit resultierendem Ungleichgewicht in der mikrobiologischen Darmflora. Das Überwiegen des Keimes Clostridium difficile führt zur Induktion einer sogenannten „pseudomembranösen Kolitis“ (benannt nach dem endoskopischen Bild der Pseudomembranen). Die Behandlung erfolgt mit Metronidazol (Clont®) oder oralem Vancomycin.
Die Behandlung der Diarrhö nach immunonkologischer Therapie ist im Abschnitt Nebenwirkungen immunonkologischer Therapien beschrieben.
2.3.5 Pflegerische Maßnahmen
Neben der sofort eingeleiteten medizinischen Behandlung mit Antidiarrhoika, Flüssigkeits- und Kalorienzufuhr sind die speziellen pflegerischen Maßnahmen entscheidend. Im Allgemeinen wird die Pflege vom Patienten selbst als erstes über die Störung in der Körperfunktion unterrichtet. Damit fällt ihr die Aufgabe zu, die entsprechenden Informationen hinsichtlich der Dringlichkeit zu bewerten und differenziert an die behandelnden Ärzte weiterzugeben. Eine sichere Beurteilung durch das Pflegepersonal hilft dem Arzt, rasch und gezielt Maßnahmen zu ergreifen.
Die Beurteilung des Zustandes eines Patienten mit Diarrhö liegt vor allem an Folgenden: Häufigkeit des Stuhlgangs, Volumen, Konsistenz, Farbe und eventuelle Beimengungen, Art des Stuhlabganges, ob er z. B. von Schmerzen begleitet ist. Des Weiteren ist darauf zu achten, ob der Patient Anzeichen von Volumen- und Flüssigkeitsmangel, wie z. B. Durst oder eine besonders trockene Haut zeigt.
Zu den speziellen pflegerischen Maßnahmen gehört neben der Körperhygiene des Patienten ganz besonders die Analhygiene. Im Zusammenhang mit der Diarrhö treten häufig im Bereich des Enddarms Erkrankungen auf, die lästig und äußerst schmerzhaft sein können. Dies kann sich in Fissuren, Abszessen und Ekzemen äußern. Um diese Komplikationen möglichst gering zu halten, ist die Einhaltung der sorgfältigen Analhygiene Voraussetzung. Ist diese vom Patienten selbst nicht durchführbar, muss das Pflegepersonal für eine umsichtige Pflege sorgen.
Patienten mit Abwehrschwäche erfordern ein sehr behutsames Vorgehen. Neben dem Durchführen einer sorgfältigen Analhygiene ist besonders auf die Vermeidung von Verletzungen zu achten, beispielsweise beim Fiebermessen, bei der Gabe von Suppositorien und Einläufen. Zum Schutz des perianalen Hautbereiches kann Fettsalbe eingesetzt werden, zur Schmerzbehandlung lokalanästhesierende Salben. Sitzbäder, gegebenenfalls mit Zusatz von Kamillelösung oder Desinfizienzien, verschaffen dem Patienten oft Erleichterung. Treten in diesem Bereich schwer behandelbare Wunden auf, sollte frühzeitig an die interdisziplinäre Zusammenarbeit mit einem proktologisch versierten Arzt gedacht werden.
Pflegerische Maßnahmen aus dem komplementär-medizinischen Bereich [1]: Zur Bindung von Toxinen im Darm und um damit deren Wirkung zur lindern, eignen sich Nahrungsmittel und Teezubereitungen, die Pektine oder Schleimstoffe enthalten. Einen Apfel sehr fein reiben oder eine Banane zerquetschen und mit einer Gabel schlagen, bis ein zäher Brei entsteht, beides sollte frisch verabreicht werden. Gerbstoffhaltige Heiltees können zur Stabilisierung der gereizten Darmschleimhaut beitragen. Dazu 1 Teelöffel schwarzer Tee mit 150 ml kochendem Wasser übergießen, bedeckt 10 Min. ziehen lassen und 2- bis 3-mal täglich eine Tasse trinken. Nicht gleichzeitig mit Medikamenten anwenden, mind. 1 Stunde Abstand. Nicht anwenden bei Einnahme von Tamoxifen und Gerinnungshemmern.
2.4 Gastritis und Ösophagitis
2.4.1 Ursache
Als Ursache gelten neben der medikamentösen Behandlung mit Zytostatika die Behandlung mit Kortikoiden, nichtsteroidalen Antirheumatika und Salizylaten, z. B. Aspirin. Alkohol und Stress können das Krankheitsbild verstärken. Komplizierend kann es zu Superinfektionen der entzündeten Schleimhaut, z. B. mit Candida albicans, kommen. Bei Nachweis einer Stomatitis ist es wahrscheinlich, dass diese Entzündung auf das Epithel des Ösophagus und des Magens übergreift.
2.4.2 Symptome
Die Veränderungen an der Speiseröhre zeigen sich beim Patienten durch Schwierigkeiten beim Schlucken fester Nahrung, das Gefühl, einen Kloß im Hals zu haben, Schmerzen beim Schlucken jeglicher Nahrung und Flüssigkeit und retrosternalen Beschwerden. Die Gastritis führt zu einem epigastrischen Druckgefühl, verbunden mit Völlegefühl oder Übelkeit. In gravierenderen Fällen ist die Ausbildung einer erosiven Gastritis möglich. Diese geht mit Oberbauchschmerzen, Hämatemesis oder Teerstuhl einher. Weitergehend ist die Ausbildung von Ulzerationen in Ösophagus und Magen denkbar.
2.4.3 Diagnose
Die Diagnose kann bei entsprechender klinischer Symptomatik durch den Arzt einfach gestellt werden. In seltenen Fällen ist es erforderlich, die Diagnose mittels Gastroskopie zu sichern. Immer erforderlich ist eine Gastroskopie beim Auftreten von Hämatemesis oder Teerstuhl. Bei Verdacht auf obere gastrointestinale Blutung dient die endoskopische Untersuchung dabei nicht nur dem Nachweis einer Blutungsquelle, sondern gleichzeitig einer endoskopischen Therapie, wie Unterspritzung, Argonplasma-Beamer-Intervention oder Clip-Applikation.
2.4.4 Therapeutische Interventionen
Von medikamentöser Seite steht die Therapie mit Protonenpumpenhemmern (Omeprazol, Pantoprazol etc.) und Prokinetika (Metoclopramid, Domperidon) im Vordergrund. Eine analgetische Therapie ist meist erforderlich. An topischen Lösungen eignet sich dabei eine Kombination aus Magnesiumhydroxid, Aluminiumhydroxid und Lidocain (Tepilta® Suspension). Diese Suspension ist Säure neutralisierend und lokal analgetisch wirksam. Bei ausgeprägten Ösophagitiden und Gastritiden ist eine orale Nahrungsaufnahme nicht mehr möglich, sodass zügig eine parenterale Ernährung einschließlich einer entsprechenden Hydratation erforderlich wird. Zur analgetischen Therapie eignet sich transdermales Fentanyl oder Morphin-Viskose-Lösung. Bei Superinfektionen mit Candida albicans ist Fluconazol wirksam und auch als Saft verfügbar.
Trotz subjektiver Belastung für den Patienten ist die Prognose der Ösophagitis und Gastritis grundsätzlich gut und es kommt zur Abheilung binnen einer Woche.
2.4.5 Pflegerische Maßnahmen
Einer der bedeutsamsten pflegerischen Aspekte beim Auftreten einer Ösophagitis ist die Erhaltung oder Förderung einer genügenden Nahrungszufuhr zur Optimierung des Allgemeinzustandes und die Beratung des Patienten bezüglich Ernährung und Risikofaktoren. Der Patient sollte informiert werden, dass spezielle Diäten sich als wenig wirksam erwiesen haben. Man kann dem Patienten raten, alles zu essen, worauf er Lust hat, was er verträgt und was ihm keine Schmerzen verursacht. Jeder Patient reagiert anders, deswegen sollte er es selbst testen.
Vitamin-, protein- und kalorienreiche Nahrung ist hilfreich, sollte aber nicht um jeden Preis eingesetzt werden. Die Kost kann eventuell püriert werden. Mit Milch, Joghurt, Hüttenkäse, Eiscreme oder auch mit warmen und kalten Gemüsecremesuppen kann diese Zeit oft überbrückt werden. Dem Patienten sollte empfohlen werden, zusätzliche chemische Reize, wie Alkohol, Nikotin und Koffein, zu vermeiden.
Ein systemisch wirksames Schmerzmittel, jeweils eine halbe Stunde vor der Nahrungsaufnahme verabreicht, kann die Nahrungszufuhr eventuell erleichtern. Einzunehmende Medikamente, welche die Magenschleimhaut reizen, wie z. B. Antibiotika, sollten, falls nicht eigens verordnet, nicht auf leeren Magen eingenommen werden.
Bei einer Ösophagitis als Therapiefolge ist eine Sondenernährung oder intravenöse Kalorienzufuhr meist nicht erforderlich, außer bei ausdrücklichem Wunsch des Patienten. Eine Alternative dazu bieten hyperkalorische Präparate, die über den Tag verteilt in kleinen Portionen zu trinken sind.
Die Aufgabe des Pflegepersonals bei einer Gastritis ist es, säurebindende und säureproduktionshemmende Medikamente zu verabreichen und deren Einnahme zu überwachen.
2.5 Stomatitis/Mukositis
Veränderungen der Schleimhäute stellen in der Pflege von Tumorpatienten, die eine Chemotherapie oder Strahlentherapie erhalten, ein häufig auftretendes Problem dar. Die Stomatitis, die Entzündung der Mundschleimhaut, ist bei Tumorpatienten das am häufigsten auftretende Problem der Schleimhaut.
2.5.1 Ursache
Die Ursachen sind in erster Linie die Toxizität der Chemotherapie oder der Strahlentherapie, die veränderte Immunlage in Folge der Leukozytopenie, aber auch die Tumorinfiltration in die Schleimhäute durch lymphatische Tumoren und Tumoren des blutbildenden Systems. Ein besonderes Risiko hierfür besteht bei Chemotherapie mit z. B. Methotrexat, Bleomycin, 5-Fluorouracil und Anthrazyklinen und in der hochdosierten Chemotherapie mit Cyclophosphamid, die in einigen Fällen bei allogener Knochenmarktransplantation angewendet wird. Ein weiterer Risikofaktor ist die lokale Radiotherapie, kombiniert mit vorhergehender oder eventuell anschließender Chemotherapie. Falls eine Stomatitis nach Chemotherapie auftritt, ist etwa zwischen dem 7. und 14. Tag nach der Applikation der Zytostatika damit zu rechnen. Bei lokaler Radiotherapie kann sie schon wenige Tage nach Therapiebeginn auftreten.
Verstärkende Faktoren sind:
- mechanische Schädigungen der Schleimhäute, z. B. durch unzureichendes Zähneputzen mit ungeeigneten Hilfsmitteln
- thermische Schädigungen, z. B. durch zu heiße Speisen
- chemische Schädigungen, z. B. durch Nikotin und Alkohol
- individuelle Risikofaktoren des Patienten selbst durch einen schlechten Allgemein- und Ernährungszustand
Die Auswirkungen einer Stomatitis auf den Patienten sind vielfältig: Geschmacksveränderungen, Appetitlosigkeit, verringerte Nahrungsaufnahme, Gewichtsverlust, Entzündungen in der Mundhöhle, Keimverschleppung in die Speiseröhre, Keimverschleppung in die Lunge, Eintrittspforte für Keime in die Blutbahn, Ulzerationen, Blutungen, Schmerzen, kosmetische Beeinträchtigungen und mangelnde Compliance.
Aufgrund dessen ist es besonders wichtig, dass das Pflegepersonal die Ursachen einer Stomatitis, deren Verlaufsform und die fachgerechte Behandlung genau kennt und durchführen kann. Zur angepassten Behandlung einer Stomatitis gehören neben den durchzuführenden Maßnahmen vor allem auch die Erfassung des Zustandes der Mundhöhle (Gradeinteilung) und die Verlaufskontrolle.
2.5.1.1 Stomatitis durch Infektionen mit Pilzen
Die am häufigsten auftretenden Infektionen der Mundschleimhaut sind Pilzinfektionen, hervorgerufen meist durch Candida albicans. Diese Candidose wird auch oft Soor-Stomatitis genannt. Das Erscheinungsbild von Candida albicans in der Mundhöhle zeigt sich durch weiche, weiße oder gelbliche Flecken, meist ausgedehnt über die ganze Zunge und/oder an der Mukosa der Mundhöhle (siehe Abbildungen rechts). Subjektiv geben die Patienten meist keine Schmerzen, aber Geschmacksempfindungsstörungen an. Das Gefühl von Watte auf der Zunge und Appetitlosigkeit nehmen zu.
2.5.1.2 Stomatitis durch Infektionen mit Viren
Virale Infektionen sind am häufigsten bedingt durch Herpes simplex oder Varicella zoster; sie treten vereinzelt oder mit gehäufter Bläschenbildungen auf, die nach zirka 12 Stunden aufbrechen und deren Exsudat verkrustet. Häufig sind Ulzerationen und Nekrosebildung sichtbar; sie befinden sich an Lippen, am Übergang zur Mundschleimhaut, an der Zunge, am Zahnfleisch oder am oberen Gaumen. Subjektive Symptome beim Patienten sind Pruritus, Brennen, starke Schmerzen bei der Nahrungs- und Flüssigkeitsaufnahme und beim Sprechen.
2.5.1.3 Stomatitis durch Infektionen mit Bakterien
Bakterielle Infektionen sind eher selten und werden meist durch gramnegative Erreger hervorgerufen, hauptsächlich durch Pseudomonas. Ein anderer Erreger bakterieller Infektionen ist der grampositive Staphylococcus aureus. Pseudomonas-Infektionen in der Mundhöhle zeigen sich häufig in gehobenen Läsionen, umschlossen von einem roten Ring, deren Zentrum gelblich-weiß und sehr trocken ist. Damit einhergehend ist oft ein sehr übler Geruch.
Jede Form der Stomatitis determiniert zur Superinfektion insbesondere mit Candida albicans (Soor-Stomatitis). Neben der Schmerzhaftigkeit kommt es bei einer Stomatitis auch oft zu einer für den Patienten unangenehmen Hypersekretion.
Die Diagnose der Stomatitis ist durch klinische Inspektion leicht zu stellen.
2.5.2 Präventive Maßnahmen
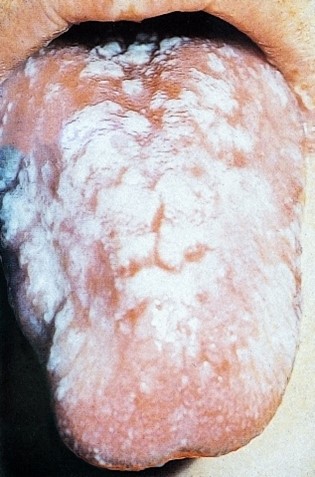
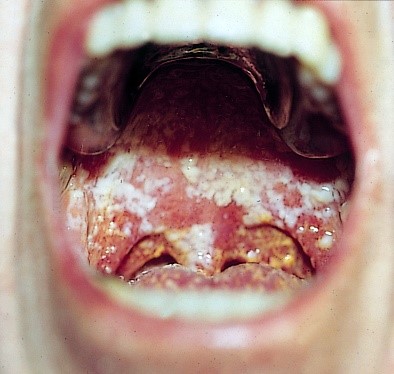
Um eine Stomatitis zu vermeiden oder das Ausmaß einer erwarteten Stomatitis möglichst gering zu halten, sind präventive Maßnahmen erforderlich. Durch eine saubere, intakte Schleimhaut können diese Ziele am ehesten erreicht werden. Die Prävention beginnt bereits bei der Zytostatika-Applikation, z. B. Lutschen von Eiswürfeln während einer 5-FU-Bolusgabe. Ist die Schleimhaut schon vor Therapiebeginn verändert, so bedeutet dies einen mangelhaften Selbstreinigungsmechanismus der Schleimhaut. Bleiben Speisereste im Mund zurück und zersetzen sich, wird die Schleimhaut zusätzlich gereizt. In der Regel wird deshalb Risikopatienten geraten, neben einer sorgfältigen Zahnreinigung, die dreimal täglich durchgeführt wird, jeweils vor und nach dem Essen Mundspülungen durchzuführen und den Erfolg zu kontrollieren. Entscheidend zur Durchführung dieser Maßnahmen ist die richtige Anleitung des Patienten durch das onkologische Pflegepersonal.
Das Ziel der präventiven Mundpflege ist die Verhütung von Infektionen und Schmerzen, das frühe Erfassen von Störungen und die Förderung des Wohlbefindens sowie einer guten Ernährung der Patienten. Besonders wichtig werden diese Aspekte vor einer kurativen Chemotherapie mit schleimhauttoxischen Medikamenten in hoher Dosierung oder vor lokalen Radiotherapien.
2.5.3 Diagnostik
Unter klinischen Gesichtspunkten werden insgesamt vier Schädigungsgrade unterschieden:
| Grad I | Rötung der Mundschleimhaut |
| Grad II | vereinzelte kleine Ulzerationen oder weiße Flecken keine wesentlichen Probleme beim Essen und Trinken |
| Grad III | ineinanderfließende Ulzerationen oder weiße Flecken auf mehr als 25 % der Mundschleimhaut nur noch Trinken möglich |
| Grad IV | blutende Ulzerationen auf mehr als 50 % der Mundschleimhaut Essen und Trinken nicht mehr möglich |
Bei einer erstgradigen Schädigung treten schmerzlose Ulzera sowie erythematöse Schleimhautschwellungen auf. Die Stomatitis II. Grades zeichnet sich durch das Auftreten schmerzhafter Erytheme, Ödeme oder Ulzera aus, wobei die normale orale Nahrungsaufnahme möglich ist. Bei einer drittgradigen Schädigung ist eine orale Nahrungsaufnahme nicht mehr vollständig möglich, während bei einer viertgradigen Schädigung eine parenterale Ernährung erforderlich wird.
Frühstadien einer Stomatitis können rechtzeitig erfasst werden, wenn die Mundinspektion regelmäßig von erfahrenen Ärzten oder Pflegenden durchgeführt wird. Häufig wird die Stomatitis bei ambulant behandelten Patienten vom Patienten selbst zuerst bemerkt. Da eine Stomatitis überall an der Mundschleimhaut auftreten kann, ist es unerlässlich, wiederholt den Zustand der Mundschleimhaut, des Zahnfleisches und der Zähne zu kontrollieren und den Ausgangsbefund schriftlich festzuhalten. Hilfreich kann hierbei die Checkliste für die Inspektion der Mundhöhle sein (Tabelle unterhalb).
Die Kontrolle der Mundhöhle wird immer mit Taschenlampe und Spatel durchgeführt. Dies ist in erster Linie Aufgabe des Arztes, aber auch die Pflegenden sollten solche Kontrollen durchführen, denn bedingt durch die häufige Präsenz beim Patienten können sie oft das Auftreten oder Verlaufsveränderungen einer Stomatitis früher wahrnehmen. Bei Patienten mit einem hohen Risiko, eine Stomatitis zu entwickeln, sollte diese Kontrolle täglich stattfinden. Es ist erforderlich und sinnvoll, Patienten ausführlich über das mögliche Auftreten einer Stomatitis zu informieren, da sie entscheidend zur Früherkennung beitragen können. Vor allem Patienten, die ambulant behandelt werden, sollten lernen, die Mundhöhle selbstständig zu kontrollieren, um frühzeitig die geeigneten Maßnahmen einleiten zu können.
| Mundhöhle | Normales Erscheinungsbild | Pathologisches Erscheinungsbild |
| Lippen | geschmeidig, feucht, rosa, intakt | trocken, spröde, aufgesprungen, Rhaghaden, blass, blau, stark gerötet, geschwollene Bläschen frisch/abklingend/schmerzhaft |
| Zunge | geschmeidig, feucht, rosa, intakt | trocken, Beläge leicht/dick/weißlich/gelb/braun, Borken, Furchen, Aphthen, stark gerötet, geschwollen |
| Mukosa | geschmeidig, feucht, rosa, intakt | trocken, Beläge leicht/dick/weißlich/gelb/braun, Aphthen, Ulzerationen, stark gerötet, geschwollen |
| Gingiva | straff, feucht, rosa, intakt | trocken, Zahnfleischschwund, geschwollen, blass, Ulzerationen, stark gerötet, Blutung, schmerzhaft |
| Zähne | glänzend, fester Sitz, intakt | stumpf, sitzen locker, Karies, spitze/scharfe Kanten |
| Zahnprothese | guter Sitz, komplett | sitzt locker, Druckstellen, kann nicht getragen werden, inkomplett |
| Speichel | dünnflüssig, ausreichender Fluss | zähflüssig, viskös, Speichelfluss vermehrt/reduziert/nicht vorhanden |
2.5.4 Behandlung bei bestehender Stomatitis / Pflegerische Maßnahmen
Das Ziel der Behandlung einer bestehenden Stomatitis ist die rasche Abheilung der Entzündung und Vermeidung einer Superinfektion.
Die Durchführung der Mundpflege ist meist unangenehm für den Patienten und kann deshalb auch Spannungen zwischen Patient und Pflegeteam hervorrufen. Oft gelingt es nur mit viel Geduld, den Patienten immer wieder neu zu motivieren.
Motivationsgründe zur Durchführung der Mundpflege können sein: bessere Nahrungsaufnahme bei gereinigter Schleimhaut und Zunge, bessere Wirkung der lokalen Schmerzmittel, insgesamt qualitativ und quantitativ bessere Nahrungsaufnahme und Vermeiden von parenteraler Ernährung. Diese Einsicht zu vermitteln und die einzelnen pflegerischen Maßnahmen beim Patienten durchzuführen, stellt eine hohe pflegerische Herausforderung dar.
An supportiven medikamentösen Behandlungsmaßnahmen stehen desinfizierende Spüllösungen (z. B. Hexetidin), antimykotisch wirksame Spüllösungen (z. B. Nystatin und Amphotericin B) und Spüllösungen mit Lokalanästhetika (lidocainhaltige Lösungen) zur Verfügung. Auch die Beimengung von Steroiden zu diesen Spüllösungen kann die klinische Symptomatik bessern.
Zur Therapie einer Soor-Stomatitis müssen zusätzliche lokale Antimykotika, z. B. Ampho-Moronal-Suspension® oder Nystatin-Suspension® verabreicht werden. Diese Maßnahmen müssen alle 4 Stunden, bei stark immunsupprimierten Patienten noch häufiger durchgeführt werden. Bei ausgedehntem Candida-albicans-Befall und Anzeichen oder Gefahr einer systemischen Pilzinfektion wird eine zusätzliche systemische Therapie mit Antimykotika (Fluconazol, Itraconazol) durchgeführt.
Bei Herpes simplex auf Lippen- oder Mundschleimhaut kann meist nur symptomatisch zur Linderung beigetragen werden. Um eine Ausdehnung zu verhindern, kann systemisch zusätzlich Aciclovir verabreicht werden. Die lokale Anwendung von Aciclovir ist sehr begrenzt, weil das Gel nur im frühen Stadium aufgetragen wirksam ist, bevor eigentliche Bläschen sichtbar werden. Zudem ist es bei offenen Bläschen äußerst schmerzhaft, sodass hier analgetische Maßnahmen erforderlich werden. Die Mundhygiene und die verordnungsgemäße Verabreichung aller lokalen Maßnahmen stehen an erster Stelle.
Da bei ausgeprägten Stomatitiden eine topische analgetische Therapie nicht ausreichend ist, können klassische Analgetika bis hin zu Morphinderivaten erforderlich werden. Hier hat sich in der Praxis die Applikation von transdermalem Fentanyl bewährt.
Neben diesen rein medikamentösen Maßnahmen werden von den Patienten auch physikalische Maßnahmen, wie Lutschen gefrorener Bonbons, als angenehm empfunden.
Hinweise und Informationen zum Symptommanagement bei Stomatitis sind in folgender Tabelle aufgeführt.
| Problem | Ziel | Maßnahmen |
| Patient kann Spülung nicht selbstständig durchführen | kontinuierliche Infektprophylaxe gewährleisten |
|
| Leichte Rötung, dünner Belag | intakte Schleimhaut, Erhalt der Kau-Schluck-Funktion |
|
| Schleimhautbeläge, Borken | glatte, rosige Schleimhaut |
|
| Ulzerationen, Aphthen | intakte Schleimhaut |
|
| Herpes Lippen Mundschleimhaut |
Schmerzlinderung, Begrenzung des Befalls |
|
| Zäher Speichel | Verflüssigung des Speichels, guter Speichelfluss |
|
| Mundtrockenheit | Befeuchten der Mundschleimhaut, Förderung des Speichelflusses, ausreichende Flüssigkeitszufuhr |
|
| Rötung, Schwellung (bei Strahlentherapie) |
Linderung, Erhalt der Kau-Schluck-Funktion |
|
| Schmerzen (bei schwerer Stomatitis) |
Linderung bzw. Schmerzfreiheit | 1) Schmerztherapie:
|
| Blutung | Blutung stoppen |
|
Die Vorgehensweise zur Pflege einer Stomatitis, die Häufigkeit der durchzuführenden Maßnahmen und die Auswahl der angewendeten Substanzen wird sicher jede Abteilung und jede onkologische Praxis in eigenen Leitlinien entscheiden. Hervorzuheben hierbei ist vor allem die Rolle des Pflegepersonals bei der exakten Durchführung der besprochenen Maßnahmen. In der nachfolgenden Tabelle ist eine Auswahl bewährter Mundpflegemittel aufgeführt. Bei muzinhaltigen Substanzen ist darauf zu achten, dass diese z. T. Gelatine und andere Bestandteile aus Schweinefleisch enthalten; muslimische und andere Patienten, die aus religiösen Gründen auf Schweinefleisch verzichten, sind diesbezüglich zu informieren.
| Mundpflegemittel | Wirkung | Anwendung |
| Kamille | entzündungshemmend bakteriostatisch fungistatisch wundheilungsfördernd Vorsicht: austrocknend | Tee: 1 Essl. (3 g)/150 ml H2O, lose Ware (Blüten) ist reicher an Wirkstoffen als Teebeutel (enthalten hauptsächlich Stengel) |
| Salbei | entzündungshemmend antibakteriell fungistatisch virostatisch | Tee: 1 Teel. (3 g)/150 ml H2O Tinktur: Druckstellen betupfen |
| Caphosol® | mucosa-adhäsive Schutzschicht | siehe Gebrauchsinformation |
| Gelclair® | mucosa-adhäsive Schutzschicht | siehe Gebrauchsinformation |
| MuGard® | mucosa-adhäsive Schutzschicht | siehe Gebrauchsinformation |
| Hexoral® | bakteriostatisch fungistatisch entzündungshemmend schmerzlindernd | unverdünnt zum Spülen |
| Betaisodona® Mund-Antiseptikum | bakteriostatisch fungistatisch virostatisch enthält 36 Vol. % Alkohol | siehe Gebrauchsinformation |
| Ampho-Moronal®- Suspension | antimykotisch stark adhäsive Eigenschaften | Behandlung von Soor 2 ml im Mund verteilen 2 ml herunterschlucken Einwegspritze zur Applikation verwenden |
| Dynexan®-Gel | schmerzstillend entzündungshemmend | erbsengroßes Stück Salbe auf betroffene Stelle auftragen |
| Glandosane® | keine Wirkung nachgewiesen wohltuend | Mundschleimhaut besprühen je nach Bedarf des Patienten |
| Saliva® | schleimhautbefeuchtend steigert das Wohlbefinden des Patienten bakteriostatisch | Mundschleimhaut besprühen je nach Bedarf den Patienten |
| Xylocain Viskös 2 %®-Gel | schmerzstillend | Gel im Mund verteilen, auch vor der Mundspülung und vor dem Essen Vorsicht: Aspirationsgefahr! |
2.6 Xerostomie
Eine besondere Form der Mundschleimhautveränderungen stellt die Xerostomie, die abnorme Mundtrockenheit, dar.
2.6.1 Ursache
Sie ist Folge von verminderter bis fehlender Produktion von Speichel. Hauptsächlich tritt sie auf nach lokaler Radiotherapie im HNO-Bereich bei Mitbestrahlung der Speicheldrüsen oder nach chirurgischen Eingriffen im HNO-Bereich. Das Ausmaß hängt von der Ausdehnung des Eingriffs und der Anzahl betroffener Speicheldrüsen ab. Aber auch einige Medikamente können, meist vorübergehend, eine mildere Form von Mundtrockenheit bewirken. Dazu gehören vor allem: Opiate, Antidepressiva, Neuroleptika, Anti-emetika, Antihistaminika, Spasmolytika, Diuretika.
2.6.2 Symptome
Auftretende Mundtrockenheit wird als erstes vom Patienten beklagt. Sie äußert sich durch schwerfälliges Sprechen, die Zunge klebt am Gaumen und der Geschmackssinn nimmt ab, da die Nahrung nicht mehr genügend mit Speichel vermischt wird. Des Weiteren klagt der Patient oft über zähen Speichel und es bereitet ihm Mühe, ihn zu schlucken. Die pflegerischen Maßnahmen zielen im Wesentlichen auf die Linderung der Symptome und die Vermeidung weiterer Komplikationen ab.
Patienten mit Xerostomie sind Risikopatienten für Stomatitis und Infektionen der Mundhöhle, da eine trockene Schleimhaut für Schädigungen jeglicher Art anfälliger ist. Auch Karies und Parodontose treten häufiger auf.
2.6.3 Therapeutische/Pflegerische Maßnahmen
Neben dem Einsatz von Speichelersatzstoffen, wie z. B. Saliva oder künstlicher Speichel (z. B. Glandosane®), sollten die Patienten dazu angehalten werden, ihre Lippen feucht zu halten, z. B. mit Vaseline, und zur Vermeidung von Karies und Parodontose Zähne und Zahnfleisch sorgfältig zu pflegen und eine intensive Mundpflege durchzuführen.
Zur Befeuchtung der Mundschleimhaut sollte neben der häufigen Zufuhr von Flüssigkeit, z. B. durch Wasser, Tee und Bouillon, Eis zum Lutschen gegeben werden. Auch können zuckerfreie Bonbons oder Kaugummis die Speichelproduktion wieder fördern.
Zur Verhütung von Irritationen und Verletzungen der Mundschleimhaut sind harte, grobe und stark gewürzte Nahrungsmittel zu vermeiden. Scharfe und saure Getränke, wie Zitrussäfte und Apfelsaft, sind in dieser Zeit nicht angezeigt. Auf Nikotin- und Alkoholabstinenz ist ganz besonders Wert zu legen. Bei Prothesenträgern muss täglich die Mundhöhle auf Druckstellen kontrolliert werden.
Zum Ausgleich des Geschmacks- bzw. Appetitverlustes sollte man dem Patienten empfehlen, Nahrungsmittel mit starkem Eigengeschmack zu sich zu nehmen. Der Patient kann so wenigstens mit seiner Nase den Geschmack erahnen und wird meist ausreichend Nahrung zu sich nehmen. Eine kalorien- und proteinreiche Ernährung in dieser Zeit hilft, eine xerostomie-bedingte Gewichtsabnahme zu vermeiden.
2.7 Seltene gastrointestinale Toxizitäten
Als seltene gastrointestinale Nebenwirkungen sind chemotherapeutisch induzierte Pankreatitiden oder Hepatitiden zu nennen. Diese sollen hier nur der Vollständigkeit halber erwähnt werden.
Literatur (Mundpflege)
Beisel C et al (2017) Mukositis. Onkologische Pflege 7(2), 19–24
Gottlieb T (2020) Alltägliche Pflegephänomene wieder in den Fokus rücken. Prozessoptimierung am Beispiel der oralen Mukositis. Onkologische Pflege 10(4), 41–44
Nieweg RMB (1997) Mundschleimhautveränderungen und Mundpflege bei Chemotherapie. Palliativpflege. Ullstein Mosby, Berlin
Schilling G & Hell Ch (2018) Orale Mukositis. KOKpedia Nebenwirkungen. Onkologische Pflege 8(3), 71–72
Wylegalla C et al (2013) Prävention und Management der oralen Mukositis. Forum Onkologische Pflege 3(3), 48–57
3 Gonadale Toxizität (Keimdrüsenschädigung)
Durch die zytostatische Chemotherapie kann sowohl die Fertilität des Mannes als auch die der Frau geschädigt werden. Maximalvariante ist die therapieinduzierte Infertilität. Das Ausmaß der gonadalen Schädigung ist vom Alter des Patienten, von der Art und auch der Dosis der verwendeten Zytostatika abhängig. Neben der Schädigung der Fertilität können auch Veränderungen der Sexualhormonspiegel auftreten. Dies kann sich klinisch in Hormonmangelerscheinungen äußern, wie z. B. herabgesetzter Libido oder erektiler Dysfunktion beim Mann. Veränderungen der Geschlechtshormonspiegel können negative Einflüsse auf das kardiovaskuläre Risiko, den Knochenstoffwechsel und das psychische Wohlbefinden der Patienten ausüben.
3.1 Ursache
Von pathophysiologischer Seite gehören sowohl beim Mann als auch bei der Frau die Fortpflanzungszellen zu den schnell proliferierenden Geweben, sodass diese durch Zellgifte bevorzugt geschädigt werden.
Dem steht beim Mann die sogenannte Blut-Hoden-Schranke gegenüber, die nur von Zytostatika bestimmter Molekülgröße passiert werden kann; somit ist ein gewisser protektiver Faktor gegeben. Die männliche Infertilität resultiert aus einer Schädigung des Keimepithels in den Hodentubuli, die hormonellen Störungen treten durch Schädigung der Leydigschen Zwischenzellen (testosteronproduzierende Zellen des Hodens) auf.
Bei der Frau kommt es zu einer Schädigung der Ovarien mit vorzeitiger Induktion der Menopause. Beispiele für Zytostatika, die spermatotoxisch sind und auch ovarielle Dysfunktionen auslösen: Chlorambucil, Cyclophosphamid, Busulfan, Lomustin, Fluorouracil, Mitomycin C. Darüber hinaus sind wahrscheinlich auch Anthrazykline und Vinca-Alkaloide auf die Fortpflanzungsorgane von Mann und Frau schädigend.
Bei der männlichen Infertilität unterscheidet man die akute von der chronischen Infertilität. Die akute Infertilität macht sich zirka 6 Wochen nach Therapiebeginn bemerkbar durch eine Abnahme der Zahl an funktionsfähigen Spermien. Etwa 12 Wochen nach Therapieabschluss kann mit einer Erholung gerechnet werden. Die chronische Phase ist definiert über den Schaden am Germinalepithel. Sie ist klinisch bedeutsamer als die akute Phase, da die Regeneration der Keimzellen langwierig sein kann und auch irreversible Schäden nicht auszuschließen sind. Als Maximalvariante gilt die zytostatikainduzierte Azoospermie.
3.2 Prävention und Therapie
Es stehen verschiedene präventive Maßnahmen zur Minimierung der gonadalen Toxizität zur Verfügung. Im Rahmen von Strahlentherapien ist der Einsatz einer Hodenschutzkapsel obligat. Männlichen Patienten sollte vor Therapiebeginn eine Sperma-Kryokonservierung angeboten werden. Dabei wird Sperma in flüssigem Stickstoff tiefgefroren, das später zur künstlichen Insemination verwendet werden kann.
Eine ähnliche Asservierung von Eizellen bei Frauen ist prinzipiell denkbar, jedoch setzt diese Maßnahme eine hormonelle Stimulation voraus, die bis zur Ausreifung der Eizelle etwa 12 Tage dauert. Da bei hochmalignen Erkrankungen, wie Leukämien und Lymphomen, eine zügige Therapieeinleitung gefordert ist, kann nicht so lange gewartet werden. Aber man kann durch antihormonelle Maßnahmen, insbesondere durch die Applikation von GnRH-Analoga, einen Schutz des Keimepithels induzieren, insoweit, als die zentrale Reifungsstimulation der Eizellen, die über FSH und LH ausgelöst wird, ausfällt, sodass die Proliferationsrate des Keimepithels reduziert wird.
Insbesondere bei hochmalignen und behandelbaren Malignomen, wie Leukämien, Lymphomen oder Hodentumoren, ist vor Therapiebeginn die Aufklärung des Patienten über die Infertilitätsschädigung dringend erforderlich. Insbesondere die Möglichkeit zur Sperma-Kryokonservierung sollte erörtert werden, da es sich bei diesen Patientengruppen um junge Patienten handelt, deren Familienplanung zum Therapiezeitpunkt meist nicht abgeschlossen ist.
3.3 Mutagenität und Teratogenität
Neben Schädigungen der Fertilität sind Zytostatika teratogen und mutagen.
Mutagenität = Schädigung der Keimzellen der Eltern durch ein Zytostatikum; bei Befruchtung ist mit Missbildungen des Fötus zu rechnen.
Teratogenität = Schädigung des Fötus im Mutterleib durch ein Zytostatikum; zu den Manifestationen zählen Abort und Totgeburt, anatomische Defekte und Fehlbildungen und prä- und postnatale Entwicklungsstörungen einschließlich Verhaltensstörungen.
Dabei gilt das 1. Trimenon der Schwangerschaft als besonders empfindlich gegenüber der schädigenden Wirkung der Zytostatika, wohingegen im 2. und 3. Schwangerschaftstrimenon keine schwerwiegenden Fehlbildungen berichtet wurden.
Alle Chemotherapiepatienten sind darauf hinzuweisen, unter der Chemotherapie keine Kinder zu zeugen oder schwanger zu werden. Eine sichere Kontrazeption – bei Mann und Frau – stellt einen essenziellen Bestandteil des Aufklärungsgesprächs vor zytostatischer Chemotherapie dar.
4 Hämatologische Toxizitäten
4.1 Allgemeine Grundlagen der Knochenmarkdepression
4.1.1 Diagnostik
Die unter zytostatischer Chemotherapie erforderlichen regelmäßigen Blutbildkontrollen richten sich nach der Intensität der Chemotherapie und somit nach der zu erwartenden Knochenmarkschädigung.
Die Blutbildung beim gesunden Erwachsenen erfolgt ausschließlich im Knochenmark (intramedulläre Blutbildung). Daneben kann es bei malignen Erkrankungen, die das Knochenmark infiltrieren, zu einer Blutbildung in Leber und Milz kommen (extramedulläre Blutbildung). Physiologischerweise entstehen alle Blutzellen aus den pluripotenten Stammzellen, die nach Differenzierung und Reifung an das periphere Blut abgegeben werden. Dort ist die Aufgabe der neutrophilen Granulozyten die Abwehr bakterieller Infektionen, die der Lymphozyten die Abwehr viraler Infektionen.
4.1.2 Ursache
Dieser physiologische Prozess kann durch verschiedene Ursachen gestört sein:
- Infiltration des Knochenmarks durch eine Leukämie, ein Lymphom oder einen soliden Tumor, z. B. Mammakarzinom, Bronchialkarzinom, Plasmozytom
- infektionsinduzierte Knochenmarkschädigung, insbesondere durch Virusinfekte, z. B. Parvovirus B19, Zytomegalievirus, HIV etc.
- Schädigung der Knochenmarkzellen durch Zytostatika, z. B. Cyclophosphamid, Doxorubicin, Epirubicin, Paclitaxel, Etoposid u. v. m.
- toxische Schädigung des Knochenmarks durch Chemikalien oder Medikamente, z. B. Benzol, Chloramphenicol, Ganciclovir etc.
- Knochenmarkschädigung durch Bestrahlung
Knochenmarkzellen gehören zu den schnell proliferierenden Zellen und werden deshalb durch Zytostatika bevorzugt geschädigt. Dies gilt sowohl für die pluripotenten Stammzellen als auch für sämtliche Vorstufen der drei myelopoetischen Reihen (Leuko-, Erythro- und Thrombozytopoese).
Das myelotoxische Potenzial der Zytostatika bestimmt die Applikationsintervalle der Chemotherapie. So können Therapien mit 5-Fluorouracil wöchentlich erfolgen, da diese Substanz so gut wie keine Knochenmarktoxizität zeigt, während Therapien mit Alkylanzien zumeist in 3- bis 4-wöchigen Abständen erfolgen. Bei Doxorubicin, Epirubicin, Irinotecan oder Taxanen kann das Applikationsintervall über die Dosierung bestimmt werden, z. B. „niedrige“ Dosis wöchentlich oder „hohe“ Dosis 3-wöchentlich.
4.1.3 Symptome
| Blutbildveränderung | Hauptnebenwirkung |
| Erythrozytenabfall = Anämie | Sauerstoffunterversorgung (Blässe, Müdigkeit, Kopfschmerzen, Schwindel, Sehstörungen, geringe Belastbarkeit, Herzrasen) |
| Leukozytenabfall = Leukopenie | Infektionen (Stomatitis, Soor, Pneumonie, Bronchitis, Gastritis, Genitalinfektionen, Wundinfektionen) |
| Thrombozytenabfall = Thrombopenie | Blutungen (Hämatome, Hämatemesis, Teerstuhl, Petechien, Zahnfleischblutungen, Schleimhautblutungen, Hämaturie, vaginale Blutungen) |
4.2 Anämie
4.2.1 Diagnostik
Unter einer Anämie (= Blutarmut) versteht man eine Verminderung des Hämoglobingehaltes < 12 g/dl bei Frauen und < 14 g/dl bei Männern; meist sind auch Hämatokritwert und Erythrozytenzahl vermindert. Die normale Lebensdauer eines Erythrozyten beträgt 120 Tage.
Die Bildung der roten Blutkörperchen erfolgt im Knochenmark über die Zwischenstufen verschiedener Normoblasten. Die direkten Vorläuferzellen der Erythrozyten werden als Retikulozyten bezeichnet.
4.2.2 Ursache
Neben den im Abschnitt Knochenmarkdepression genannten Ursachen ist die Anämie von Tumorpatienten als multifaktorielles Geschehen aufzufassen. Die Anämie ist die häufigste hämatologische Komplikation bei Krebspatienten. Sie kann als Folge der Krebserkrankung selbst oder als Folge der Therapie (Operation, Chemo- und/oder Radiotherapie) auftreten. So spielen bei der Genese der Tumoranämie neben der Chemotherapie (Nebenwirkung) auch Eisenverluste durch chronische Blutungen und malignombedingte Umverteilungen des Eisens in das retikulohistiozytäre System (RHS) eine Rolle.
An dieser Stelle sei auf ein besonderes Krankheitsbild hingewiesen: die aplastische Anämie. Es handelt sich um eine Autoimmunerkrankung, bei der sich Antikörper gegen die pluripotenten Stammzellen richten oder isoliert gegen Vorläuferzellen der Erythrozyten (pure red cell aplasia).
4.2.3 Symptome
Physiologischerweise dienen die Erythrozyten dem Sauerstofftransport, sodass die klinische Symptomatik aus einem verminderten Sauerstoffangebot, bedingt durch verminderte „Trägerkapazität“, resultiert.
Die klinische Symptomatik hängt vom Ausmaß der Anämie und vom Allgemeinzustand der Patienten ab (z. B. Alter, Ernährungszustand). Klinische Symptome einer Anämie treten meistens erst bei Hämoglobinwerten < 10 g/dl auf und sind in ihrer Ausprägung altersabhängig, d. h. jüngere Patienten tolerieren niedrige Hämoglobinwerte besser als ältere Patienten. Insgesamt ist die Anämie von Tumorpatienten ein Faktor, der zur reduzierten Leistungsfähigkeit beiträgt.
Klinische Symptome einer Anämie können sein:
- Konzentrationsstörungen und Müdigkeit (fehlender Sauerstoffgehalt zerebral)
- Sehstörungen und Kopfschmerzen
- Verwirrungszustände (insbesondere bei älteren Patienten)
- Luftnot (meist bei Belastung, in schwereren Fällen auch in Ruhe)
- Blässe und Zyanose der Lippen und Akren
- Tachykardie (dient als Kompensationsmechanismus)
- Brustschmerzen ähnlich einer Angina pectoris
4.2.4 Therapeutische Interventionen
Therapeutisch steht bei der Anämiebehandlung die Bluttransfusion im Vordergrund. Durch eine Bluttransfusion mit normalerweise zwei Erythrozytenkonzentraten kann der Hämoglobingehalt schnell und sicher angehoben werden, sodass der Patient zügig von seiner Anämiesymptomatik befreit oder gebessert wird. Nebenwirkungen einer Bluttransfusion sind in erster Linie allergische Reaktionen, daneben sind auch Infektionen mit Hepatitisviren denkbar. Prinzipiell sind Bluttransfusionen beliebig oft wiederholbar und die meisten Tumorpatienten sind polytransfundierte Patienten.
Eine weitere Möglichkeit der Anämiebehandlung stellt die Gabe von Erythropoietin dar. Dieses Zytokin stimuliert einerseits die Bildung von Erythrozyten aus den pluripotenten Stammzellen und hemmt andererseits den Abbau der bereits gebildeten Erythrozyten (Antiapoptosefaktor). Die Überlebenszeit eines Erythrozyten unter Erythropoietinbehandlung liegt bei über 120 Tagen. Da eine Erythropoietinbehandlung nur bei ausreichenden Eisenvorräten sinnvoll ist, kann gegebenenfalls eine Eisensubstitutionstherapie erforderlich werden. Mit Darbepoeitin steht ein Molekül mit deutlich längerer Halbwertszeit zur Verfügung. Dieses kann vorteilhafterweise parallel zur jeweiligen Chemotherapie in wöchentlichen, 2-wöchentlichen oder auch 3-wöchentlichen Intervallen verabreicht werden.
Die Anämie bei Tumorpatienten ist auch ein Parameter, der auf das Ansprechen der zytostatischen Chemotherapie einen Einfluss hat. Eine Hypoxie im Tumorgewebe kann die Wirkung der Zytostatika herabsetzen. Der Hämoglobinspiegel bei Chemotherapiepatienten sollte zwischen 10–12 g/dl liegen, sowohl niedrigere als auch höhere Werte können mit einer Prognoseverschlechterung einhergehen. Allerdings konnte bislang ein positiver Einfluss hoher Hämoglobinwerte durch Erythropoietinbehandlung auf die Gesamtüberlebenszeit der Patienten nicht nachgewiesen werden.
4.2.5 Pflegerische Maßnahmen
Ein wichtiger pflegerischer Aspekt ist die Aufklärung über die Wichtigkeit der Ernährung. Die Beurteilung von Nahrungsaufnahme, Appetit- oder Gewichtsveränderungen und auch die Beachtung einer ausreichenden Flüssigkeitsaufnahme ist notwendig. Ruhe- und Entspannungsphasen sollten geplant und Aktivitäten gefördert werden. Patienten mit einer schweren Anämie bedürfen einer sorgfältigen Beobachtung. Die pflegerischen Tätigkeiten beziehen sich auf die Kontrolle des zu transfundierenden Präparates, die Einstellung der Tropfgeschwindigkeit nach ärztlicher Verordnung, die Kontrolle der Vitalzeichen, Puls, Blutdruck, Atmung und Temperatur vor Beginn, während der Transfusion und nach Beendigung der Transfusion.
Bei ersten Anzeichen einer Transfusionsreaktion sollte die Transfusion sofort unterbrochen werden. Da das Risiko von Unverträglichkeitsreaktionen mit zunehmender Zahl an Transfusionen steigt, ist bei den Patienten vor allem auf die zunehmende Sensibilisierung zu achten. Unverträglichkeitsreaktionen sind Schüttelfrost, Unruhe, Beklemmungsgefühl, eventuelle Atemnot, plötzlich auftretende Übelkeit und Erbrechen, Kopfschmerzen, Exantheme, eventuelle Schockzeichen, wie z. B. Tachykardie, Blutdruckabfall und Nierenversagen.
Als Sofortmaßnahme bei Unverträglichkeitsreaktionen sind neben dem Abbruch der Transfusion die Alarmierung des Arztes und, wenn notwendig, eine Schockbehandlung erforderlich und die genaue Dokumentation aller Anzeichen und eingeleiteten Maßnahmen.
Bei allen Zwischenfällen sollten die Blutkonserve, das Begleitformular, der Transfusionsbericht und 10 ml Empfängerblut an die Transfusionszentrale zur Klärung des Vorfalles weitergeleitet werden.
4.3 Leukozytopenie (= Leukopenie)
4.3.1 Diagnostik
Unter einer Leukozytopenie versteht man die Verminderung der Leukozytenzahl unter 4000/µl Blut (Normalwert: 4000–10 000/µl). Besonders relevant für das Infektionsrisiko ist die Zahl an neutrophilen Granulozyten, einer Untergruppe der Leukozyten, die für die bakterielle Abwehr zuständig sind. Die Neutropenie wird in vier Stadien (nach ANC = absolute neutrophil count = absolute Anzahl der neutrophilen Granulozyten) eingeteilt:
| Grad 1 | 2000–1500/µl |
| Grad 2 | 1500–1000/µl |
| Grad 3 | 1000–500/µl |
| Grad 4 | < 500/µl |
Als diagnostische Basismaßnahmen bei neutropenischem Fieber gelten eine Infektionsanamnese (Husten? Schnupfen? Heiserkeit? Brennen beim Wasserlassen? Durchfall?), eine körperliche Untersuchung, die Entnahme von Blutkulturen im Fieberanstieg (Trefferquote maximal 20 %), eine Urinuntersuchung mit Teststreifenanalyse und Kultur sowie eine Untersuchung von Rachenspülflüssigkeit (Kultur). Weiterhin ist eine Röntgenuntersuchung des Thorax in zwei Ebenen obligat. Alle weiterführenden Untersuchungen hängen dann von den erhobenen Befunden ab.
4.3.2 Symptome
Wichtigstes Symptom einer Infektion bei neutropenischen Patienten ist das Fieber. Jede Temperatur über 38,0 °C bei einem neutropenischen Patienten erfordert eine zügige Diagnostik und ist deshalb immer sofort – auch nachts – dem behandelnden oder diensthabenden Arzt mitzuteilen.
Während Leukozytopenien mit Leukozytenzahlen > 2000/µl und/oder Neutropenien mit Granulozytenzahlen > 1000/µl klinisch nicht bemerkt werden, verlaufen Leukozytopenien < 1000/µl und/oder Neutropenien < 500/µl nahezu immer mit Infektionen. Die Infektgefährdung des Patienten steigt daneben weiter mit zunehmender Dauer der Zytopenie. Niedrigrisikopatienten (Neutropenie-Dauer < 10 Tage) sind alle Patienten mit konventionell dosierten Chemotherapien, aber auch Patienten nach einfacher zytostatischer Hochdosistherapie mit Stammzelltransplantation! Hochrisikopatienten (Neutropenie-Dauer > 10 Tage) sind insbesondere Leukämiekranke und Patienten nach Knochenmark- oder Stammzelltransplantation mit vorheriger Ganzkörperbestrahlung.
Als Nadir bezeichnet man die Phase des niedrigsten Standes der Blutzellzahl nach einer Chemotherapie, meist 7–14 Tage nach Beginn der Chemotherapie. In diesem Zeitraum ist der Patient am anfälligsten für Infektionen. Die Neutropenie kann
- ohne Anzeichen verlaufen,
- mit unklaren Anzeichen, wie Müdigkeit, Schwäche, Schwitzen und Veränderungen der Schleimhäute, einhergehen,
- mit deutlichen Anzeichen, wie Schüttelfrost, Fieber, Infektionen der Atemwege, des Harntraktes und des Nervensystems, verlaufen; der Auslöser für die Infektionen sind oft Bakterien, die den Darm oder die Haut der Betroffenen besiedeln; eine Entzündung kann bei einer Granulozytenzahl < 500/µl atypisch verlaufen, d.h. dass am Infektionsherd aufgrund der fehlenden Granulozyten oft wenig oder kein Eiter produziert wird;
- eine Sepsis auslösen, ohne dass Fieber auftritt.
4.3.3 Therapeutische Interventionen
Neutropenie wird oft nicht als klinisch signifikant angesehen, solange die Zahl nicht unter 1000/µl fällt. Tritt Fieber im Zusammenhang mit niedrigem ANC auf, wird dieses als febrile Neutropenie bezeichnet. Diese stellt immer einen Notfall dar und muss sofort behandelt werden.
Entscheidende Maßnahme ist eine sofortige Antibiotikatherapie, deren Intensität sich am Zustand des Patienten und an der Dauer der Neutropenie orientiert (meist Kombinationstherapien aus zwei verschiedenen Antibiotika). Erweiterungen des antimikrobiellen Therapieregimes um antimykotische und in seltenen Fällen auch um antivirale Maßnahmen können erforderlich sein. Je nach erwarteter Dauer der Neutropenie werden darüber hinaus Wachstumsfaktoren wie Filgrastim oder Lenograstim (Neupogen® oder Granocyte®) eingesetzt. Darüber hinaus steht mit Pegfilgrastim (z. B. Neulasta®) ein pegylierter Wachstumsfaktor zur Verfügung, der nur einmal im gesamten Chemotherapiezyklus appliziert wird. Pegfilgrastim wird über die neu gebildeten Granulozyten eliminiert (Granulozytenclearance), sodass die Wirkung automatisch nach Restitution der Granulopoese endet. Diese sollen die Ausreifung der pluripotenten Stammzellen in Richtung Leukozyt beschleunigen. Wachstumsfaktoren sind bei kurzer Neutropeniedauer nach konventionell dosierter Chemotherapie nicht erforderlich, nach Hochdosistherapien mit Stammzelltransplantation jedoch obligat.
Merke: Wachstumsfaktoren beeinflussen nicht den Abfall der Leukozyten, d. h. der niedrigste Wert bleibt unbeeinflusst, sondern verkürzen nur die zeitliche Dauer der Leukozytopenie.
Die Therapie nosokomial erworbener Infektionen erweist sich wegen der gehäuft beteiligten gramnegativen Bakterien oft als sehr schwierig. Besonders gefürchtet ist die gramnegative Sepsis durch Pseudomonas aeruginosa.
Bei immunsupprimierten Patienten spielen darüber hinaus auch sogenannte opportunistische Infektionen (Tabelle unterhalb) eine wichtige Rolle. Darunter versteht man Infektionen durch Krankheitserreger, die bei einem immungesunden Organismus keine Krankheiten auslösen können, weil sie durch das funktionsfähige Immunsystem abgetötet werden. Unter Chemotherapie, nach Knochenmarktransplantation und bei HIV-Patienten können sich diese Erreger jedoch im Organismus ausbreiten und Krankheiten auslösen.
| Erregerklasse | Erreger | Erkrankung |
| Pilze | Candida albicans Aspergillus fumigatus Cryptococcus neoformans | Soor-Ösophagitis, Soor-Stomatitis Aspergillose, Pneumonie Meningitis |
| Protozoen | Pneumocystis carinii Toxoplasma gondii | Pneumocystis-carinii-Pneumonie Toxoplasmose |
| Viren | Zytomegalievirus Herpes-simplex-Virus Varicella-Zoster-Virus | Pneumonie, Meningitis, Retinitis ulzerierende mukokutane Läsionen Herpes zoster |
| Bakterien | Mycobacterium avium Mycobacterium tuberculosis | atypische Mykobakteriose Pneumonie, Lymphadenopathie |
4.3.4 Pflegerische Maßnahmen
Da Infektionen bei Tumorpatienten immer noch zu den häufigsten Todesursachen zählen, kommt deren Vorbeugung auch durch das Pflegepersonal eine besondere Bedeutung zu. Neben der aktuellen Leukozytenzahl und der voraussichtlichen Dauer der Neutropenie spielen folgende Faktoren eine wichtige Rolle: die Prognose des Patienten, die weiteren geplanten Therapien, der Immun- und der Ernährungsstatus des Patienten, aber auch seine Begleiterkrankungen und das Spektrum der Krankenhauskeime.
Allgemeine Empfehlungen zur Verhütung von Infektionen sind:
- übliche Maßnahmen zur Wahrung einer optimalen Asepsis anwenden
- Hygiene und Instruktion des Krankenhauspersonals bei Händewaschen und Desinfektion
- Besucher auf Infektionszeichen überprüfen, besonders Virusinfektionen
- Blumen im Zimmer wegen Gefahr bakterieller Kontamination vermeiden
- Menschenansammlungen vermeiden
Spezielle Empfehlungen für den Patienten:
- Hände waschen bzw. desinfizieren nach der Toilettenbenutzung und vor dem Essen
- einmal täglich mit einer antimikrobiellen Waschlotion waschen oder duschen; gründliche Intimpflege nach der Stuhlentleerung
- Handtücher und Unterwäsche täglich wechseln
- Haut täglich eincremen, damit sie nicht austrocknet, rissig wird und sich dadurch entzündet
- neue weiche Zahnbürste benutzen
- intensive Mundpflege und Beobachtung der Schleimhäute
Besonders wichtig ist es, Infektionen frühzeitig zu erkennen. Dazu gehört es, die Körpertemperatur des Patienten genau zu überprüfen, die gesamte Haut zu beachten, insbesondere Hautfalten sowie Schleimhäute. Alle Veränderungen, die auf eine Infektion hinweisen könnten, sind sofort dem betreuenden Arzt mitzuteilen.
Besondere Maßnahmen sind:
- sorgfältige Pflege von Venenverweilkathetern
- Beobachtung der Haut auf Entzündungszeichen an der Kathetereinstichstelle
- sorgfältige Körperpflege des Patienten
- Überprüfung der Mundhöhle auf Infektionen
- sorgfältige Perianalpflege nach jedem Stuhlgang
Die besondere Aufmerksamkeit des Pflegepersonals muss septischen Patienten gelten. Hier müssen engmaschige Kontrollen der Vitalzeichen durchgeführt werden, um einen septischen Schock rechtzeitig erkennen und entsprechende Notfallmaßnahmen einleiten zu können.
4.4 Thrombozytopenie (= Thrombopenie)
4.4.1 Diagnostik
Unter einer Thrombozytopenie versteht man die Verminderung der Thrombozytenzahl unter 150 000/µl Blut (Normalwert: 150 000–300 000/µl).
Thrombozyten werden aus pluripotenten Stammzellen im Knochenmark gebildet. Nach Differenzierung entstehen unter Einwirkung von Thrombopoietin Megakaryozyten, aus diesen durch Abschnürungen aus dem Zytoplasma Thrombozyten.
Wesentliche Funktion der Thrombozyten ist die „Blutstillung“, auch als primäre Hämostase bezeichnet. Dabei bildet sich ein Thrombozytenkonglomerat, das eine Gefäßläsion primär verschließt. Erst danach kommt es durch die Aktivierung von Gerinnungsfaktoren zur eigentlichen Blutgerinnung (sekundäre Hämostase).
4.4.2 Ursachen
Ursachen einer Thrombozytopenie können medikamentös, infektiös oder toxisch sein. Bei den infektiösen Ursachen sei besonders auf das Parvovirus B-19 hingewiesen, das bei Kindern die sogenannten Ringelröteln auslöst, bei Erwachsenen und/oder immunsupprimierten Patienten jedoch isolierte Thrombozytopenien induzieren kann. Auch protrahierte (= verzögerte) Restitutionen der Thrombozytenzahl können durch das Parvovirus B-19 bedingt sein. Zytostatika, wie z. B. Mitomycin C und Lomustin (CCNU), können protrahierte Thrombozytopenien auslösen, die teilweise 4–5 Wochen nach Chemotherapie noch andauern.
4.4.3 Symptome
Klinisch werden Thrombozytopenien erst bei Unterschreiten der sogenannten kritischen Thrombozytenzahl (< 30 000/µl) evident. Leitsymptom einer Thrombozytopenie ist der petechiale Blutungstyp, d. h. Auftreten von stecknadelkopfgroßen Hautblutungen, insbesondere an den abhängenden Körperpartien (Unterarme, Beine). Darüber hinaus finden sich jedoch auch gehäuft Nasen- und Zahnfleischblutungen, intraabdominelle Blutungen oder sogar intrazerebrale Blutungen.
Merke: Finden sich Petechien auf dem Integument, so bestehen auch Petechien an den Eingeweiden (auch wenn diese einer Inspektion nicht zugänglich sind).
4.4.4 Therapeutische Interventionen
Wichtigste Maßnahme bei ätiologisch unklarer thrombozytopenischer Blutung oder chemotherapeutisch induzierter Thrombopenie ist die Gabe von Thrombozytenkonzentraten oder Zellseparatorpräparaten. Eine Thrombozytentransfusion ist immer bei Thrombozytenzahlen < 10 000/µl erforderlich, auch ohne das Vorhandensein von Blutungszeichen. Bei darüber liegenden Thrombozytenzahlen ist die Transfusion nur bei Blutungszeichen indiziert. Bei 10 000–20 000 Thrombozyten/µl können Thrombozytenkonzentrate in bestimmten Sondersituationen auch ohne Blutungszeichen erforderlich sein, z. B. bei septischen Patienten, vor invasiven Eingriffen, Harnblasenkathetern etc.
Das Anlegen einer Thrombozytentransfusion wird vom Arzt durchgeführt. Die Tropfgeschwindigkeit wird nach ärztlicher Verordnung eingestellt. Im Allgemeinen wird eine sehr kurze Infusionsdauer angestrebt.
Bei einer Transfusionsreaktion muss die Transfusion sofort abgebrochen werden und bei Bedarf eine Schockbehandlung eingeleitet werden. Alle Zwischenfälle müssen exakt dokumentiert werden und mit dem Thrombozytenpräparat, einem Begleitformular, dem Transfusionsbericht und 10 ml des Empfängerblutes an die Transfusionszentrale zur Klärung der Ursache geleitet werden. Zur Vermeidung oder Verringerung von Transfusionsreaktionen können bei bekannter Überempfindlichkeitsreaktion des Empfängers vor Transfusionsbeginn vom Arzt verordnete Antihistaminika und Kortikosteroide verabreicht werden.
Bei Patienten mit Morbus Werlhof (Autoimmunthrombozytopenie, idiopathische thrombozytopenische Purpura ITP) oder hämolytisch-urämischem Syndrom (HUS) ist unabhängig von der Thrombozytenzahl jede Thrombozytengabe kontraindiziert!
Bei Blutungen mit Abfall des Hämoglobingehaltes sind zudem Erythrozytentransfusionen erforderlich. Ergänzt werden diese Maßnahmen durch die Gabe von Frischplasmapräparaten (GFP oder PPSB) bei vital bedrohlichen Blutungen oder bei Blutungen aus einem soliden Tumor.
Gefürchtet ist die thrombozytopenische intrazerebrale Blutung mit meist fulminantem Verlauf und einer sehr schlechten Prognose. Alle anderen Blutungen sind prognostisch besser einzustufen und durch die oben genannten Maßnahmen in aller Regel beherrschbar. Bei gastrointestinalen Blutungen finden neben den medikamentösen Maßnahmen auch endoskopische Verfahren, wie Unterspritzung mit Adrenalin, Applikation von Fibrinkleber, Argon-Beamer- oder Laserinterventionen, Anwendung. Voraussetzung dafür sind eine lokalisierte Blutungsquelle und das Fehlen einer diffusen Blutung.
Zur Behandlung der Thrpmbopenie bei ITP stehen Thrombopoeitin-Mimetika wie Elthrombopag oder Romiplostim zur Verfügung. Diese haben jedoch keine Zulassung für die chemotherapie-induzierte Thrombopenie.
4.4.5 Pflegerische Maßnahmen
Das Auftreten massiver Thrombozytopenien kann für den Patienten eine lebensbedrohliche Situation darstellen. Eine sorgfältige Überwachung und Pflege dieser Patienten ist daher von besonderer Bedeutung. Eine genaue Beobachtung des Patienten auf Haut- oder Schleimhautblutungen bei allen pflegerischen Maßnahmen spielt hier eine ganz besonders wichtige Rolle.
Merke: Patienten mit Thrombozytopenie müssen täglich nach Blutungsstigmata befragt und angesehen werden, d. h. Frage nach Veränderung der Stuhlfarbe (Teerstuhl), Blutbeimengungen zum Urin, Nasen- oder Zahnfleischbluten. Die Haut als Spiegel der inneren Organe ist täglich zu inspizieren. Faktoren, die das Blutungsrisiko erhöhen, sind: hoher Blutdruck, erhöhte Körpertemperatur und Obstipation.
Allgemeine Aufklärung über Schutzmaßnahmen
- Vermeidung anstrengender Tätigkeiten, mechanischer Verletzungen und Kontaktsportarten
- optimaler Ernährungszustand (erhöhte Eiweißzufuhr) und erhöhte Flüssigkeitszufuhr
- Aufklärung über tägliche Selbstuntersuchung (Haut, Stuhl etc.) des Patienten und der Angehörigen
- Aufklärung über Maßnahmen und Behandlung von Blutungen
Maßnahmen zur Prävention von Hauteinblutungen
- durchblutungsfördernde Maßnahmen (heißes Baden, Sauna, Dampfbäder, Massagen, Fango) sind zu vermeiden
- auf Petechien, Ekchymosen und Purpura achten
- Vermeidung von Traumen und Punktionen, insbesondere i.m und s.c. Injektionen
- Reduktion der Zahl an peripheren Venenpunktionen, Anlegen eines Druckverbandes nach einer solchen Punktion
- Vermeiden von Nassrasuren; Verwendung von elektrischen Rasierapparaten, falls nicht kontraindiziert: Haarentferner anwenden, gegebenenfalls auf die Rasur verzichten
- Vorsicht beim Schneiden und Feilen von Finger- und Fußnägeln
- Vermeidung von sehr enger Kleidung und engen Schuhen
- bei Blutdruckmessungen Verwendung der geringsten notwendigen Drücke
Maßnahmen bei Hauteinblutungen
- bei großen Hämatomen Auflegen von Quarkauflagen und Coolpacks
- Versorgung von blutenden Wunden mit Druckverbänden
- spezielle Maßnahme nur nach Absprache mit dem Arzt (Salben etc.)
Maßnahmen zur Prävention von Nasenbluten
Um Nasenbluten zu vermeiden, sollte der Patient darüber aufgeklärt werden, die Nase nur vorsichtig zu schnäuzen und bei trockenen Schleimhäuten eine Nasensalbe zu applizieren. Anfeuchten der Luft nur, wenn keine Neutropenie besteht.
Maßnahmen bei Nasenbluten
- Blutdruck im Kopfbereich senken: bei liegenden Patienten Rückenlehne aufrichten, Beine tief lagern
- kalte Kompresse oder Coolpacks auf den Nacken legen, um eine reflektorische Schleimhautkontraktion zu erreichen
- Nasenflügel der blutenden Seite fest mit dem Finger an die Nasenscheidewand pressen (Kompression der Gefäße)
- bei anhaltender Blutung Tamponade der Nase mit Mullstreifen (speziellere Maßnahmen nur mit Rücksprache mit Arzt)
Maßnahmen zur Prävention von Blutungen im Mundbereich
- Empfehlung einer zahnärztlichen Untersuchung und Behandlung, falls erforderlich, vor Therapiebeginn
- um Blutungen im Mundbereich zu vermeiden, empfiehlt es sich, keine besonders harten, heißen und scharfen Speisen zu sich zu nehmen, und die Lippen einzucremen, um deren Austrocknen zu vermeiden
- zum Zähneputzen sollten keine harten Zahnbürsten verwendet werden; stattdessen eine sanfte Reinigung mit Mundspülung/Munddusche, Watteträgern oder Schaumstoffzahnbürste
- interdentale Reinigungsmittel wie Zahnseide oder harte Mundduschen sollten in dieser Zeit unterbleiben
- Untersuchung der Schleimhäute auf Blutungsquellen auch unterhalb der Zahn-/Teilprothesen
Maßnahmen bei Blutungen im Mundbereich
- bei Blutungen Rücksprache bezüglich spezieller Maßnahmen mit dem Arzt halten
Maßnahmen zur Prävention von Blutungen im Magen-Darm-Trakt
- um Blutungen im Magen-Darm-Trakt zu vermeiden, sollten Einläufe, Suppositorien und Rektalmessung vermieden werden
- Vermeidung von Obstipation
- auf Blutungssymptome (kaffeesatzartiges Erbrechen, teerfarbenen Stuhl) achten
- Vitalzeichenkontrolle, vor allem RR und Puls
Maßnahmen bei Blutungen im Magen-Darm-Trakt
- spezielle Maßnahmen (systemisch/topisch) nur nach Rücksprache mit dem Arzt
- nach jedem Toilettengang weiches Toilettenpapier, Softnetkompressen und Olivenöl zur Reinigung benützen
- auf eventuelle Kontraindikationen (Wärmflasche, feucht-heiße Auflagen etc.) achten
Maßnahmen zur Prävention von Blutungen im Urogenitaltrakt
- um Blutungen im Urogenitaltrakt zu verhindern, sind Katheterisierung bzw. Vaginalduschen nur unter sehr strenger Indikation einzusetzen
- Urin auf Blutbeimengungen überprüfen
- Empfehlung geben, beim Geschlechtsverkehr Gleitmittel zu verwenden
Maßnahmen zur Prävention von Blutungen im ZNS
- um Blutungen im ZNS zu vermeiden, sollte eine medikamentöse Unterdrückung von Erbrechen und Husten erfolgen, um intrakranielle Druckerhöhungen zu vermeiden; desgleichen sind Vorsichtsmaßnahmen zur Verhütung von Krampfanfällen zu treffen (nach ärztlicher Anordnung)
- Vermeidung von Obstipation
- Vermeidung von Luftanhalten und Pressen beim Stuhlgang oder beim Aufrichten im Bett u. a.
- Beobachtung des Patienten auf eventuell auftretende Symptome (Schwindel, Erbrechen, Somnolenz etc.), um rechtzeitig erforderliche Maßnahmen einzuleiten
5 Hepatotoxizität
5.1 Ursache
Leberschädigungen sind prinzipiell unter jeder zytostatischen Chemotherapie denkbar, da die Leber das zentrale Organ der Metabolisierung und Entgiftung der applizierten zytostatischen Chemotherapeutika ist. Ebenfalls kann eine Hepatotoxizität durch Tyrosinkinase-Inhibitoren ausgelöst werden, da auch diese einem hepatischen Metabolismus unterliegen. Als Beispiel kann hier Crizotinib angeführt werden. Auch hormonelle und antihormonelle Therapien können zu einer Erhöhung der Leberwerte führen, wichtiges Beispiel hier ist Abirateron in der Behandlung des Prostatakarzinoms.
Histopathologisch findet man mehrere Schädigungsmuster:
- Verfettung von Leberzellen mit Induktion einer Leberzirrhose
- Ausprägung von Leberzellnekrosen
- Schädigung kleinster Lebervenen im Sinne einer Venenverschlusserkrankung
- intrahepatische Cholestasen und auch die Induktion von Leberzelltumoren
5.2 Symptome
In der Regel handelt es sich bei den Leberschädigungen um Mischbilder. Klinisch ist die zytostatikainduzierte Hepatopathie meistens symptomlos und stellt einen Zufallsbefund bei der routinemäßigen Kontrolle der Leberparameter dar. Es kommt zu einem Anstieg des Bilirubins, der Transaminasen (GOT, GPT) und der Cholestaseparameter (Gamma-GT und alkalische Phosphatase). Wenn Gerinnungs- und Proteinwerte erniedrigt sind, bedeutet dies Schädigungen der Lebersynthesefunktion.
5.3 Diagnostik
Diagnostisch ist die Zuordnung zum schädigenden Agens nicht immer einfach. Transfusionsassoziierte Hepatitiden bei polytransfundierten Tumorpatienten oder Reaktivierung alter Hepatitiden im Rahmen der chemotherapeutisch induzierten Immunsuppression müssen beachtet werden. Auch Antimykotika und Antibiotika können die Leberfunktion schädigen.
Unter potenziell hepatotoxischen Therapien – und das gilt auch für Tyrosinkinase-Inhibitoren – sind regelmäßige Kontrollen der Leberwerte erforderlich.
5.4 Therapie
Nach Absetzen des auslösenden Agens ist die Leberschädigung im Allgemeinen rückläufig und die erhöhten Laborparameter bilden sich zurück. Spezifische Antidota stehen nicht zur Verfügung.
Eine besondere Form der Leberschädigung ist die Venenverschlusskrankheit (venous occlusive disease) – insbesondere bei Hochdosis-Chemotherapien und im Rahmen von Knochenmarktransplantationen – mit einer Inzidenz von bis zu 10 %. Auslösende Zytostatika können Azathioprin, Cytosinarabinosid, Procarbazin, 6-Mercaptopurin, 6-Thioguanin, Busulfan, Carmustin, Melphalan, Mitomycin C oder Etoposid sein.
Als pathologisches Korrelat gilt die nicht thrombotische Obliteration kleiner Lebervenen mit konsekutiver Bindegewebehyperregeneration, mit folgenden multiplen hepatozellulären Nekrosen.
Klinisch entwickelt sich daraus ein fulminantes Krankheitsbild mit abdominellen Schmerzen, schnell auftretendem Aszites, Thrombozytopenie und ausgeprägter Hepatomegalie. Während andere Formen der Hepatopathie harmloser Genese sind, wird die Mortalität der Venenverschlusserkrankung mit 7–50 % beziffert.
Die Therapie besteht in Heparingaben oder Prostaglandin-Infusionen. Auch Lysetherapien sind versucht worden.
Die Therapie der Hepatotoxizität nach immunonkologischer Therapie ist im Abschnitt Nebenwirkungen immunonkologischer Therapien beschrieben.
6 Immunologische Toxizität (Allergien, Hypersensitivitätsreaktionen)
Wie bei jeder medikamentösen Behandlung kann es auch bei der zytostatischen Chemotherapie zu allergischen Reaktionen kommen. Besonders häufig treten diese bei Chemotherapien mit Paclitaxel (Taxol®, getriggert vom Lösungsvermittler Cremophor EL), Bleomycin (ausgelöst durch niedermolekulare Proteine) oder bei Antikörpertherapien (z. B. Rituximab, ausgelöst durch Fremdproteine) auf. Das allergisierende Potenzial eines Antikörpers hängt von seiner Struktur ab und ist umso höher, je größer der Anteil an murinem Protein (Mäuseprotein) ist. Somit zeigen murine Antikörper die höchsten Raten an allergischen bis anaphylaktischen Reaktionen, gefolgt von chimären Antikörpern, die noch zu etwa 7 % aus murinem Eiweiß bestehen. Humanisierte und vollständig humane Antikörper bewirken so gut wie keine allergischen Reaktionen. Diese Reaktionen werden jedoch nicht nur durch Zytostatika- oder Antikörpertherapien ausgelöst, sondern treten auch im Rahmen supportiver Maßnahmen auf, am häufigsten bei Bluttransfusionen, Immunglobulingaben oder antimykotischer Behandlung mit Amphotericin B.
„Neuartige“ immunologische Toxizitäten treten durch Therapien mit immunagonistischen Medikamenten auf, z. B. CTLA-4-Antikörper Ipilimumab oder PD-1- bzw. PD-L1-Antikörper. Die 4 Haupttoxizitäten umfassen immunogene Hautreaktionen (netzartiger erythematöser Ausschlag), immunogene Diarrhö (medikamentös induzierte Colitits ulcerosa), immunogene Hepatitis (Autoimmunhepatitis) und eine immunogene Endokrinopathie (Hypophysitis).
6.1 Ursache
Reaktionen vom Soforttyp sind am häufigsten. Als Mechanismus liegt eine Immunantwort des Organismus auf einen körperfremden Stoff, das Zytostatikum, oder auch das Lösungsmittel des Medikamentes zugrunde. Es kommt insbesondere zur Histaminfreisetzung aus den Granula der basophilen Granulozyten, wodurch eine Vasodilatation (Weitstellung der Gefäße) bewirkt wird mit der Folge eines Blutdruckabfalls; konsekutiv reagiert der Organismus mit einer Tachykardie. Parallel dazu löst Histamin eine Bronchokonstriktion sowie Juckreiz (Pruritus) und Quaddelbildung (Urtikaria) auf der Haut aus.
Ursächlich bei den immunagonistischen Medikamenten ist eine „Überaktivierung“ von T-Zellen. Hier kommt es nicht zu Sofortreaktionen. Die Toxizitäten treten im Median nach 3 (Hauttoxizität) bis 9 (Diarrhö) Wochen auf, die immunogene Hypophysitis auch noch später.
6.2 Symptome
Mögliche Hinweise auf eine allergische Sofortreaktion sind:
- plötzlich einsetzende Atemnot oder pfeifendes Atemgeräusch
- Juckreiz
- Quaddelbildung auf der Haut
- Schwindelgefühl und Schwarzwerden vor den Augen
- Blutdruckabfall
- Kollapsneigung
- Anstieg der Körpertemperatur
- Schüttelfrost oder Kältegefühl
- Herzjagen oder Herzklopfen
6.3 Therapeutische Interventionen
Eine allergische Sofortreaktion kann in seltenen Fällen lebensbedrohlich sein. Man spricht dann von einem anaphylaktischen (allergischen) Schock. Da bei Auftreten der ersten Symptome nicht vorhergesehen werden kann, wie schwer die allergische Reaktion ausfällt, ist zügiges Handeln geboten. Die nachfolgende Tabelle zeigt Medikamente zur Behandlung allergischer Reaktionen. Diese Medikamente werden vom Arzt intravenös injiziert.
| Substanzklasse | Substanzname | Handelsname (Beispiele) |
| Kortikosteroide | Prednison Prednisolon Dexamethason | Solu-Decortin® Urbason® Fortecortin® injekt |
| H1-Antihistaminika | Clemastin Dimetinden | Tavegil® Fenistil® |
| H2-Antihistaminika | Cimetidin Ranitidin | Tagamet®, Cimehexal® injekt Sostril®, Ranitic® injekt |
| Katecholamine | Cafedrin + Theoadrenalin Adrenalin (= Epinephrin) | Akrinor® Suprarenin® |
| Bronchospasmolytika | Theophyllin Reproterol | Bronchoparat®, Euphylong® Bronchospasmin® |
Die Behandlung der immunvermittelten Toxizitäten von Ipilimumab basiert auf Steroiden.
6.4 Pflegerische Maßnahmen
Die Aufgaben des Pflegepersonals liegen vor allem in der Prophylaxe, in der Überwachung des Patienten und in der Therapiekontrolle. Deshalb ist es wichtig, dass das Pflegepersonal genau die eingesetzte Substanz, deren Wirkungsweise und ihre Nebenwirkungen kennt. Dazu gehören die engmaschige Überwachung des Patienten mit Blutdruck-, Puls- und Temperaturkontrolle. Besondere Warnzeichen sind beginnende Atemnot, Blutdruckabfall, Thoraxschmerzen, Bronchospasmen, Urtikaria und andere allergische Hauterscheinungen.
Bei Behandlung mit z. B. Paclitaxel oder monoklonalen Antikörpern ist es ganz entscheidend, dass die angeordnete prophylaktische Behandlung zeitgerecht vor Beginn der Therapie verabreicht wird. Die Erstgabe sollte grundsätzlich durch den behandelnden Arzt erfolgen. Kommt es trotz der Prophylaxe zu einer schweren allergischen Reaktion, muss eine sofortige symptomatische Behandlung eingeleitet werden.
Folgende Erstmaßnahmen sollten bereits bei Verdacht auf eine allergische Sofortreaktion ergriffen werden:
- Zytostatikainfusion sofort stoppen
- venösen Zugang in jedem Fall belassen
- Hochlagerung der Beine (Autotransfusion)
- Arzt verständigen, falls erforderlich über Haus- oder Reanimationsnotruf!
- Messung von Blutdruck, Puls und Temperatur
- 1000 ml Vollelektrolytlösung oder NaCl 0,9 % zur Infusion vorbereiten
Bei einem solchen Zwischenfall liegt die Aufgabe des Pflegepersonals vor allem in der Organisation aller notwendigen erforderlichen Maßnahmen und dem Beistand des Patienten in einer schwierigen Situation
7 Sekundäre Immundefekte
Norbert Schleucher
7.1 Allgemeines und Definitionen
Unter einem „Immundefekt“ versteht man allgemein gesagt eine Störung oder einen Defekt des Immunsystems, infolgedessen es seine komplexen Aufgaben insbesondere in der Abwehr von Infektionskrankheiten nur unvollständig wahrnehmen kann.
Dabei wird zwischen sogenannten primären und sekundären Immundefekten unterschieden. Primäre Immundefekte werden auch als primäre Immunstörungen, primäre Immundefizienz oder angeborene Immunschwäche bezeichnet. Sie sind prinzipiell vererbbar und somit angeboren. Klinische Beispiele für eine primäre Immundefizienz sind ein selektiver Immunglobulin-A-Mangel, das Di-George-Syndrom, Phagozytosedefekte, Störungen im Komplementsystem sowie Störungen der zellulären oder humoralen Abwehr, z. B. das Wiskott-Aldrich-Syndrom oder das SCID-Syndrom (severe combined immunodeficiency). Diese Erkrankungen werden meist im frühen Kindes- und Jugendalter diagnostiziert. In Deutschland leben etwa 3000–3500 Patienten mit primären Immundefekten (Orphan Diseases). Sie stehen hier jedoch nicht im Mittelpunkt der Betrachtung.
Deutlich häufiger sind sekundäre Immundefekte. Diese sind nicht angeboren, sondern werden im Laufe des Lebens erworben. Das kann vielfältige Gründe haben. Zu den häufigen klinischen Ursachen, die ein sekundäres Immundefektsyndrom auslösen können, gehören beispielsweise Infektionserkrankungen wie HIV-Infektion, AIDS oder Mykobakteriosen, Tumorerkrankungen (Lymphome, Leukämien, Plasmozytom etc.) oder nephrologische Erkrankungen (Niereninsuffizienz und Urämie). Auch ein enterales Eiweißverlustsyndrom, Anämien, Malnutritionssyndrome (häufigste Ursache weltweit!), Autoimmunerkrankungen und Arzneimittel, die die Zahl an weißen Blutkörperchen beeinträchtigen (Leukopenien und Granulozytopenien mit der maximalen Variante der Agranulozytose), können Auslöser sein. Darüber hinaus können Bestrahlungstherapien und Chemotherapien sowie immunsuppressive Behandlungen (z. B. Kortikosteroidbehandlungen, Einsatz von Biologika in der antirheumatischen Therapie) zu sekundären Immundefekten führen.
7.2 Klinische Symptomatik
Die klinischen Symptome eines sekundären Immundefektes sind in der Regel durch infektiologische Komplikationen gekennzeichnet. Ein wesentliches Symptom ist eine Infekthäufung mit Fieber unabhängig von der Jahreszeit. Dabei ist die Reaktion des Organismus bei Einwirkung eines infektiologischen Agens in der Regel inadäquat.
Klinische Anzeichen für primäre und sekundäre Immundefektsyndrome ergeben sich über die sogenannte ELVIS-Regel (Erreger, ungewöhnliche Lokalisation, Verlauf, Intensität und Summe [Zahl der Infektionen]), welche eine pathologische Infektanfälligkeit beschreibt, und über eine immunogene Dysregulation, die sogenannte GARFIELD-Regel (Granulome, Autoimmunität, rezidivierendes Fieber, ungewöhnliche Ekzeme, Lymphoproliferation, chronische Darmentzündung).
Differenzialdiagnostisch müssen verschiedene hämatoonkologische Krankheitsbilder berücksichtigt bzw. ausgeschlossen werden. Dazu zählen beispielsweise aplastische Anämien, Agranulozytose, ITP, heparinassoziierte Thrombozytopenie, thrombotische Mikroangiopathie, disseminierte intravasale Koagulopathie (DIC). Ebenfalls auszuschließen sind akute und chronische Leukämien (insbesondere CLL), Hodgkin- und Non-Hodgkin-Lymphome, das Immunozytom (Morbus Waldenström) sowie myelodysplastische Syndrome. Dabei erhebt diese Darstellung keinen Anspruch auf Vollständigkeit, zumal auch Diabetiker als immun-kompromittierte Patienten gelten.
Die klinische Bedeutung und Relevanz der sekundären Immunsuppression wird insbesondere bei Patienten mit chronischer lymphatischer Leukämie und mit Multiplem Myelom evident: Etwa 25–50 % der CLL-Patienten verstarben im Laufe ihrer Erkrankung an einer Infektion, bei Multiplem Myelom sind es sogar etwa 35 % der Erkrankten.
7.3 Diagnostik
Die Diagnostik eines Immundefektsyndroms ist komplex und erfolgt in der Regel in spezialisierten Zentren respektive Speziallaboratorien. Der klinische Verdacht wird zunächst durch die Anamnese und besondere Infektkonstellationen (ungewöhnliche Infektionen, gehäufte seltene Infektionen etc.) begründet. Die weitere Diagnostik erfolgt dann überwiegend laborchemisch mit Erstellung eines Differenzialblutbildes und eines Blutausstrichs sowie Durchführung einer Serum-Elektrophorese und Bestimmung der quantitativen Immunglobuline. Die immunologische Spezialdiagnostik umfasst Analysen des B-Zell-Systems wie die Bestimmung aller Immunglobulinkonzentrationen und IgG-Subklassen, Isohämagglutinine und Impf-Antikörper. Die Bestimmung der Oberflächenantigene CD19 und CD20 ist relevant (insbesondere im Hinblick auf Lymphomerkrankungen). Eine FACS(Fluorescence Activated Cell Sorting)-Durchflusszytometrie mit CD-Klassifizierung gehört ebenfalls zum diagnostischen Standard (insbesondere zur Analytik des T-Zellsystems). Auch eine Komplementfaktoren-Analyse ist regelmäßig durchzuführen. Wenn erforderlich, können auch spezielle Testungen der Phagozyten-Funktion erfolgen.
Darüber hinaus kann es erforderlich sein, zum Ausschluss von Lymphomerkrankungen Computertomografien des Halses, des Thorax sowie des Abdomens durchzuführen und gegebenenfalls pathologisch vergrößerte Lymphknoten zu biopsieren oder in toto zu exstirpieren.
7.4 Therapie
Die grundlegenden therapeutischen Optionen bei einem sekundären Immundefekt bestehen aus prophylaktischer antimikrobieller Therapie, Impfungen sowie der Immunglobulinsubstitution.
7.4.1 Antimikrobielle Prophylaxe
Je nach Risikokonstellation kommen zur antimikrobiellen Prophylaxe Antibiotika, Virustatika und Antimykotika zum Einsatz. Dabei sind bestimmte Risikofaktoren relevant, insbesondere gilt dies für eine erwartete prolongierte Neutropeniedauer von mehr als 7 Tagen. Auch Patienten und Patientinnen mit einer Neutropeniedauer unter 7 Tagen und zusätzlichen relevanten Risikofaktoren können von einer Prophylaxe profitieren.
Als Risikofaktoren gelten dabei die maligne Grunderkrankung selbst einschließlich des Tumorstadiums, die verabreichte Chemotherapie (insbesondere deren erster Zyklus!) und Komorbiditäten wie eine Herzinsuffizienz oder eine Niereninsuffizienz. Auch Patienten, die einen Chemotherapiezyklus bei bereits erniedrigter Leukozytenzahl beginnen, haben ein erhöhtes Zytopenierisiko.
Zur kurzfristigen Antibiotikaprophylaxe werden aktuell die Fluorchinolone Ciprofloxacin oder Levofloxacin empfohlen. Zur Prophylaxe einer Pneumocystis-jirovecii-Pneumonie ist Cotrimoxazol das Mittel der ersten Wahl. Dieser Erreger spielt jedoch bei Neutropenien nach zytostatischer Chemotherapie eine untergeordnete Rolle.
Im Bereich der soliden Tumoren und der myeloproliferativen Neoplasien gibt es keine generelle Empfehlung zu einer virustatischen Prophylaxe. Dies gilt auch für das Multiple Myelom, obwohl diese Einschätzung schwierig ist, da es durchaus klinische Praxis ist, Patienten mit Multiplem Myelom eine Aciclovir-Prophylaxe zu verordnen. Eine Impf-Prophylaxe mit dem Medikament Shingrix kann zumindest vereinzelt diskutiert werden (insbesondere bei Patienten mit lang anhaltender unklarer immunologischer Situation wie bei Multiplem Myelom, CLL oder malignen Lymphomen).
Eine Empfehlung zur antimykotischen Prophylaxe gibt es bei Patientinnen mit hämatologischen Neoplasien und einer erwarteten Neutropeniedauer von deutlich über 7 Tagen wie beispielsweise im Bereich der allogenen Stammzelltransplantation oder der akuten Leukämien respektive myelodysplastischer Syndrome und der aplastischen Anämie. Als empfohlenes Medikament gilt dabei das Posaconazol. Nach Standardchemotherapien bei der Behandlung solider Tumoren gibt es keine Empfehlung zu einer prophylaktischen antimykotischen Therapie.
7.4.2 Impfungen
In Akutsituationen haben Impfungen bei sekundären Immundefekten in der Regel keine Bedeutung. Dennoch sind bestimmte Impfungen auch bei onkologischen Patienten wichtig und erforderlich. Als bekanntes Beispiel gilt die Pneumokokkenimpfung bei drohender oder bereits erfolgter Splenektomie (optimalerweise Impfung vor Splenektomie). Ebenfalls von Bedeutung für immunsupprimierte Patienten sind die Impfungen gegen COVID und die Influenzaimpfung (sollte jährlich durchgeführt werden). Dabei gilt die Regel, dass Totimpfstoffe auch unter immunsuppressiver Therapie angewendet werden können. Lebendimpfstoffe jedoch sind absolut kontraindiziert!
7.4.3 Immunglobulinsubstitution
Die grundlegenden Indikationen zur Immunglobulinsubstitution bei sekundären Immundefekten sind eine pathologische Infektanfälligkeit, ein Immunglobulinmangel sowie eine pathologische Impfantwort.
Der aktualisierte EMA(European Medicines Agency)-Zulassungstext bezüglich einer Immunglobulinersatztherapie lautet: „Sekundäre Immundefizienz bei Patienten, die an schweren oder rezidivierenden Infektionen leiden, bei denen sich eine antimikrobielle Therapie als ineffektiv erwies und die entweder eine fehlende Impfantwort oder deutlich erniedrigte Ig-G Serumwerte < 4 g/l zeigen.“
Dieser Grenzwert gilt nicht
- für die Substitutionstherapie von Hypogammaglobulinämien aufgrund von hämatologischen Erkrankungen oder deren Behandlung. So beispielsweise bei der Hypogammaglobulinämiebehandlung und der Behandlung wiederkehrender bakterieller Infektionen bei Patienten mit chronischer lymphotischer Leukämie (CLL), bei denen prophylaktische Antibiotika versagt haben oder kontraindiziert waren,
- bei der Hypogammaglobulinämiebehandlung und der Behandlung wiederkehrender bakterieller Infektionen bei Patienten mit Multiplem Myelom (MM),
- bei der Hypogammaglobulinämiebehandlung bei Patienten mit prä- und postallogener hämatopoetischer Stammzellentransplantation (HSCT) [FI].
Literatur
Berger DP, Engelhardt M, Duyster J (2023) Das rote Buch: Hämatologie und Internistische Onkologie, 7. Auflage, Landsberg am Lech, ecomed Medizin
Bourke CD, Berkley JA, Prendergast AJ (2016) Immune Dysfunction as a Cause and Consequence of Malnutrition. Trends Immunol 37: 386–98
Casulo C, Maragulia J, Zelenetz AD (2013) Incidence of hypogammaglobulinemia in patients receiving rituximab and the use of intravenous immunoglobulin for recurrent infections. Clin Lymphoma Myeloma Leuk 13: 106–11
Classen AY, Henze L, von Lilienfeld-Toal M et al (2021) Prophylaxe bakterieller Infektionen und Pneumocystis jirovecii Pneumonie. Onkopedia Leitlinie, www.onkopedia.com/de/onkopedia/guidelines/bakterielle-infektionen-und-pneumocystis-jiroveci-pneumonie-prophylaxe/@@guideline/html/index.html [aufgerufen am 29.04.2024]
Dalrymple LS, Katz R, Kestenbaum B et al (2012) The risk of infection-related hospitalization with decreased kidney function. Am J Kidney Dis 59: 356–63
Fachinformation Beriglobin®, Stand April 2022; CSL Behring GmbH – Emil-von-Behring-Str.76 35041 Marburg
Feiten S, Chakupurakal G, Feustel HP et al (2019) High adherence of patients with multiple myeloma who receive treatment with immunomodulatory drugs (IMIDS) in hematology/oncology group practices in Germany. Support Care Cancer 27(11): 4265–71
Henze L, Buhl C, Sandherr M et al (2022) Management of herpesvirus reactivations in patients with solid tumours and hematologic malignancies: update of the Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society for Hematology and Medical Oncology (DGHO) on herpes simplex virus type 1, herpes simplex virus type 2, and varicella zoster virus. Ann of Hematol 101(3): 491–511
Henze L, Buhl C, Sandherr M et al (2023) Antivirale Prophylaxe: Herpes simplex Virus Typ 1, Herpes simplex Virus Typ 2, Varicella zoster Virus. Onkopedia Leitlinie, www.onkopedia.com/de/onkopedia/guidelines/antivirale-prophylaxe-herpes-simplex-virus-typ-1-herpes-simplex-virus-typ-2-varicella-zoster-virus/@@guideline/html/index.html [aufgerufen am 29.04.2024]
Herold G (2020) Innere Medizin, De Gruyter, Berlin
Na I-K, Hensel M, Maschmeyer G et al (2019) Immundefekte, sekundär. Schwerpunkt: Therapieinduzierte Immundefekte in der Hämatologie und Onkologie, Onkopedia Leitlinie, www.onkopedia.com/de/onkopedia/guidelines/immundefekte-sekundaer/@@guideline/html/index.html [aufgerufen am 29.04.2024]
Pelaj P (2018) Primäre und sekundäre Immundefekte. Journal Onkologie 11, www.journalonko.de/thema/lesen/primaere_sekundaere_immundefekte [aufgerufen am 29.04.2024]
Pelaj P (2022) MRT: 7 Tipps für den Umgang mit Angstpatient:innen. Journal Onkologie 6, www.journalonko.de/thema/lesen/mrt_7_tipps_umgang_angstpatientinnen [aufgerufen am 29.04.2024]
Perraudin C, Bourdin A, Spertini F et al (2016) Switching Patients to Home-Based Subcutaneous Immunoglobulin: an Economic Evaluation of an Interprofessional Drug Therapy Management Program. J Clin Immunol 36: 5020–10
Raanani P, Gafter-Gvili A, Paul M et al (2009) Immunoglobulin prophylaxis in chronic lymphocytic leukemia and multiple myeloma: systematic review and meta-analysis. Leuk Lymphoma 50: 764–72
Reiser M, Borte M, Huscher D et al (2017) Management of patients with malignancies and secondary immunodeficiencies treated with immunoglobulins in clinical practice: Long-term data of the SIGNS study. Eur J Haematol 99: 169–77
Rieger C, Liss B, Mellinghoff S et al (2019) Impfung bei Tumorpatienten, Onkopedia Leitlinie, www.onkopedia.com/de/onkopedia/guidelines/impfungen-bei-tumorpatienten/@@guideline/html/index.html [aufgerufen am 29.04.2024]
Sandherr M, Hentrich M, von Lilienfeld-Toal M et al (20159 Antiviral prophylaxis in patients with solid tumours and haematological malignancies – Update of the Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society for Hematology and Medical Oncology (DGHO). Ann Hematol 94(9): 14410–50
Sandherr M, Rieger CT (2024) Impfungen in der Hämatologie und Onkologie: aktuelle Standard-empfehlungen und wichtige Neuerungen. DGHO Webinar, www.onkopedia.com/de/wissensdatenbank/wissensdatenbank/impfungen-risikoadaptierte-empfehlungen/folien_rieger_sandherr-impfungen.pdf [aufgerufen am 29.04.2024]
Stemler J, Mellinghoff SC, Khodamoradi Y et al (2022) Primary prophylaxis of invasive fungal diseases in patients with haematological malignancies: 2022 update of the recommendations of the Infectious Diseases Working Party (AGIHO) of the German Society for Haematology and Medical Oncology (DGHO). J Antimicrob Chemother 78(8): 1813–26
Stemler J, Mellinghoff S, Khodamoradi Y et al (2023) Antimykotische Primärprophylaxe bei Patienten mit hämatologischen Neoplasien, Onkopedia Leitlinie, www.onkopedia.com/de/onkopedia/guidelines/antimykotische-primaerprophylaxe-bei-patienten-mit-haematologischen-neoplasien/@@guideline/html/index.html [aufgerufen am 29.04.2024]
Thiel J, Rizzi M, Engesser M et al (2017) B cell repopulation kinetics after rituximab treatment in ANCA-associated vasculitides compared to rheumatoid arthritis, and connective tissue diseases: a longitudinal observational study on 120 patients. Arthritis Res Ther 19: 101
8 Kardiotoxizität
8.1 Ursache
Als pathologischer Mechanismus liegt wahrscheinlich eine Bildung freier Radikale in den Herzmuskelzellen zugrunde. Diese freien Radikale induzieren Oxidationen von Lipiden der kardialen Mitochondrienmembranen. Da in Herzmuskelzellen ein relativer Mangel an protektiven Enzymen wie Superoxiddismutase und Glutathionperoxidase besteht, können die gebildeten Radikale nur unzureichend abgefangen werden und ihre membranoxidierenden Eigenschaften entfalten. Als pathologisches Korrelat resultiert eine Degeneration der Kardiomyozyten und eine Dilatation der myokardialen Fibrillen. Die Folge sind Verluste im Kontraktilitätsverhalten. Diese durch typische histopathologische Veränderungen charakterisierte Kardiomyopathie wird auch als Anthrazyklintyp oder Typ I Kardiomyopathie bezeichnet.
Die Entwicklung einer anthrazyklininduzierten Kardiomyopathie wird erst ab bestimmten Schwellendosen wahrscheinlich. Diese Schwellendosis beträgt bei Doxorubicin etwa 500 mg/m2 KO, bei Epirubicin etwa 900–1000 mg/m2 KO und bei Mitoxantron zirka 160 mg/m2 KO.
Klinisch entwickeln weniger als 5 % der Patienten, deren kumulative Doxorubicin-Dosis unter 450 mg/m2 KO liegt, eine Herzinsuffizienz. Bei Überschreiten dieses Schwellenwertes steigt das Risiko für eine Kardiomyopathie überproportional an. Als Risikofaktoren gelten eine hohe kumulative Dosis sowie eine hohe Einzeldosis. Auch die Applikationsdauer der Anthrazykline hat Einfluss auf die Entwicklung der Kardiomyopathie. So steigt die Schwellendosis für Doxorubicin bei Dauerinfusion auf etwa 700 mg/m2 KO im Vergleich zur Bolusapplikation an.
Als weitere Risikofaktoren gelten kardiale Vorerkrankungen, kardiotoxische Kombinationsmedikamente und ein schlechter Allgemeinzustand des Patienten. Wahrscheinlich kann auch eine stattgehabte Mediastinalbestrahlung eine anthrazyklininduzierte Kardiomyopathie auslösen.
Aufgrund der klinischen Bedeutung, insbesondere bei kurativ behandelten Patienten mit Leukämien oder Morbus Hodgkin, ist unter der Anthrazyklintherapie ein engmaschiges kardiologisches Monitoring erforderlich. Dabei haben sich Verlaufsuntersuchungen mittels Echokardiografie (Bestimmung der Ejektionsfraktion und Ventrikelmotilität) bewährt.
Ein anderer Mechanismus liegt der Trastuzumab (Herceptin®) bedingten Schädigung des Herzmuskels zugrunde. Die HER2 (ErbB2) und HER4 (ErbB4) induzierten Signalübertragungswege bewirken am Myokard eine zelluläre Proliferation der Kardiomyozyten, sodass kontraktile Elemente erneuert bzw. im Falle einer Schädigung repariert werden können. Durch die Gabe von Trastuzumab wird dieser physiologische kardioprotektive Weg (Repairmechanismus) inhibiert, sodass es zu einer Herzinsuffizienz kommt. Diese ist im Gegensatz zur anthrazyklininduzierten Kardiomyopathie in der Regel binnen 2–4 Monaten reversibel. Eine kumulative Schwellendosis oder charakteristische histopathologische Veränderungen existieren nicht. Es handelt sich um die sogenannte Typ II Kardiomyopathie oder um den Trastuzumab-Typ.
Auch Tyrosinkinase-Inhibitoren können eine kardiotoxische Wirkung zeigen. Als Prototyp ist hier das Imatinib zu nennen (Typ III Kardiomyopathie oder Imatinib-Typ). Nach 10-jähriger Therapiedauer liegt die Herzinsuffizienzrate bei 5–10 %. Als Mechanismus steht die Hemmung des ABL-Proteins (Abelson-Kinase) im Vordergrund, wodurch die Protektion der Myokardzellen gegenüber oxidativem Stress reduziert wird. Zusätzlich werden durch Hemmung der ribosomalen S6-Kinase vermehrt proapoptotische Faktoren freigesetzt, was als wesentlicher Mechanismus der Kardiotoxizität von Sunitinib (Häufigkeit 3–15 %) gilt. Da sich keine myokardialen Nekrosen ausbilden, sind die Veränderungen weitgehend – aber nicht immer vollständig – reversibel.
8.2 Symptome
Die kardiale Toxizität verschiedener Zytostatika kann sich in unterschiedlichen klinischen Manifestationen darstellen. Häufigste Kardiotoxizität ist dabei die Entwicklung einer akuten oder chronischen Kardiomyopathie mit konsekutiver Herzinsuffizienz. Darüber hinaus kann es auch zu zytostatikainduzierten entzündlichen Herzerkrankungen wie Myokarditiden und Perikarditiden kommen. Auch Herzrhythmusstörungen sowie die Verschlechterung einer vorbestehenden koronaren Herzerkrankung gehören zu den zytostatikaassoziierten kardialen Toxizitäten. Zytostatika, bei denen ein Kardiotoxizitätsrisiko gegeben ist, sind in erster Linie Anthrazykline (Doxorubicin, Epirubicin, Mitoxantron). Darüber hinaus können auch bei Behandlung mit Cytosinarabinosid, Fludarabin, 5-Fluorouracil, Paclitaxel, hochdosiertem Cyclophosphamid, Bleomycin und Cisplatin kardiale Nebenwirkungen auftreten.
Myokardiale Ischämien treten in klassischer Weise unter zytostatischer Chemotherapie mit 5-Fluorouracil, deutlich seltener unter Paclitaxel, auf. Dabei induziert 5-Fluorouracil Koronarspasmen (ein mit der sogenannten Prinzmetal-Angina vergleichbares Krankheitsbild). Klinisch äußern sich hier direkt unter der 5-FU-Infusion linksthorakale, in den linken Arm ausstrahlende Schmerzen. Bei fehlender Behandlung dieser 5-FU-induzierten Myokardischämie sind Myokardinfarkte beschrieben worden. Bei Patienten unter höher dosierter 5-FU-Therapie (Dosen 2,0–2,6 g/m2 über 24 Stunden) treten Myokardischämien in 2–16 % der Fälle auf.
Das klassische Beispiel der Kardiotoxizität ist die anthrazyklininduzierte Kardiomyopathie. Man unterscheidet zwischen einer dosisunabhängigen Frühform und einer dosisabhängigen Spätform.
Bei der dosisunabhängigen Frühform handelt es sich meistens um supraventrikuläre Herzrhythmusstörungen oder Veränderungen im Bereich der ST-Strecken, in seltenen Fällen auch um ventrikuläre Arrhythmien. Diese Toxizität tritt unter der Injektion oder Infusion auf und ist nach Beendigung der Infusion selbstlimitierend. Etwa 6–40 % der anthrazyklinbehandelten Patienten sind betroffen.
Bei der dosisabhängigen Spätform kommt es mit kumulativer Anthrazyklindosis zur Entwicklung einer Herzinsuffizienz als Ausdruck der Kardiomyopathie.
8.3 Therapeutische/Pflegerische Maßnahmen
An speziellen prophylaktischen Maßnahmen kommt der Verwendung moderner, weniger kardiotoxischer Anthrazykline wie Epirubicin oder Idarubicin eine gewisse Bedeutung zu. Auch die liposomale Verkapselung von Anthrazyklinen (liposomales Doxorubicin (Handelsname Myocet) und pegyliertes liposomales Doxorubin (Handelsname Caelyx)) kann die Kardiotoxizität reduzieren. Darüber hinaus kann auch das Medikament Dexrazoxan (verhindert toxische Einflüsse oxidierender Radikale) als Kardioprotektivum in Erwägung gezogen werden. Aufgrund des leukämogenen Potentials ist seine Bedeutung jedoch gering. Ältere Radikalfänger wie Vitamin E haben sich in der klinischen Praxis nicht bewährt. Nach einer neueren Untersuchung könnten Statine einen protektiven Effekt gegenüber Anthrazyklinen und Trastuzumab aufweisen, da diese den oxidativen Stress reduzieren [1].
Therapeutisch entsprechen die Therapierichtlinien der zytostatikainduzierten Kardiomyopathie den Richtlinien zur allgemeinen Behandlung einer Herzinsuffizienz. ACE-Hemmer gelten als Präparate der ersten Wahl, gefolgt von Diuretika einschließlich Spironolacton, Beta-Blockern und Digitalispräparaten.
In allen Fällen kardiotoxischer Einflüsse wird die Diagnose über ein typisches klinisches Bild mit korrespondierenden EKG-Veränderungen und auch Laborveränderungen gestellt. Rhythmusstörungen sind meist selbstterminierend und erfordern nur selten eine antiarrhythmische Therapie. Bei Myokarditiden oder Perikarditiden erfolgt die Behandlung mit Prostaglandin-Synthesehemmstoffen (Diclofenac, Ibuprofen). In der Akutbehandlung eines Koronarspasmus werden intravenös verabreichte Nitrate und/oder Calciumantagonisten eingesetzt. Sollte es auch unter prophylaktischer Applikation von Calciumantagonisten und/oder Beta-Blockern in Kombination mit Thrombozytenaggregationshemmern erneut zu Spasmen kommen, so ist die Fortführung der 5-FU-Behandlung kontraindiziert. Bei Kardiotoxizität sind vonseiten des Pflegepersonals keine speziellen Maßnahmen erforderlich.
Die immunogene Kardiotoxizität ist im Abschnitt Nebenwirkungen immunonkologischer Therapien beschrieben.
Literatur
- Abdel-Quadir H. et al., J Am Heart Assoc 2021; 10: e018393
9 Kieferknochennekrose
Kieferknochennekrosen treten assoziiert mit dem Einsatz von Amino-Bisphophonaten in einer hämatologischen (meist multiples Myelom) oder onkologischen (ossär metastasierter solider Tumor) Indikation auf. Die genaue Inzidenz ist unklar, unter Zoledronsäure wird die Kieferknochennekrose bei 1,3–2 % der behandelten Patienten beschrieben. 95 % sind mit einer intravenösen Bisphosphonatgabe assoziiert. In der Osteoporosetherapie ist die Kieferknochennekrose eine Rarität. Auch unter dem RANK-Liganden Inhibitor Denosumab sind Kieferknochennekrosen möglich und betreffen ca. 1,8 % der behandelten Patienten [1].
9.1 Ursache
Der genaue pathophysiologische Entstehungsmechanismus ist nicht geklärt. Beteiligte Faktoren sind jedoch die sehr gute Blutversorgung der Kieferknochen verbunden mit einem hohen Gewebe-Turn-over durch die Krafteinwirkung beim Kauen. Wichtige prädisponierende Faktoren sind vorausgegangene zahnärztliche Eingriffe, Infektionen im Kieferbereich sowie Chemo-, Strahlen- und Glukokortikoidtherapien. Oft ist eine banale Zahnextraktion unter laufender Bisphosphonattherapie Auslöser einer Kieferknochennekrose.
9.2 Symptome
Es finden sich frei liegende Knochenareale mit gelblicher-weißlicher Verfärbung an Ober- oder Unterkiefer oder am harten Gaumen. Im Randbereich können Ulzerationen und Schwellungen vorliegen. Die frei liegenden Knochenareale sind meist nicht schmerzhaft, kommt jedoch ein Infekt der umliegenden Weichteile hinzu, treten Schmerzen auf. In den klinischen Verlaufsuntersuchungen zeigen diese Herde über mehrere Wochen keine Besserungstendenz.
9.3 Diagnostik
Heute ist bereits vor Einleitung einer Bisphosphonattherapie eine zahnmedizinische Basisuntersuchung ggf. einschließlich einer Röntgenaufnahme des Kieferpanoramas obligat. Alle zahnärztlich geplanten Maßnahmen (Extraktionen, Wurzelbehandlungen etc.) sollten bei Beginn der Bisphosphonatbehandlung für 3–4 Wochen abgeschlossen sein.
Die Diagnose einer Kieferknochennekrose kann mittels Inspektion blickoptisch gestellt werden. Röntgenuntersuchungen der betroffenen Region zeigen in den Frühstadien meist einen unauffälligen Befund, erst bei fortgeschrittenen Läsionen zeigen sich mottenfraßähnliche Aufhellungen an den Knochen und teilweise auch Knochensequester.
9.4 Therapie
Eine Standardtherapie einer manifesten Osteonekrose gibt es nicht. Die Bisphosphonattherapie muss beendet werden. Das Behandlungskonzept muss für jeden Patienten individuell erstellt werden und kann kieferchirurgische Eingriffe beinhalten (Nekrosektomien, plastische Deckung der betroffenen Areale). Da jedoch auch dabei Wundheilungsstörungen auftreten können, sind konservative Maßnahmen zu bevorzugen. Diese bestehen überwiegend in desinfizierenden Maßnahmen zum „Sauberhalten“ der Wundfläche und in der Gabe von Antibiotika (Langzeittherapien bis zur Abheilung).
Präventiv sollte vor Einleitung jeder Bisphosphonattherapie eine zahnärztliche Untersuchung erfolgen, eine begonnene Zahnbehandlung sollte abgeschlossen sein. Die Patienten müssen auf eine ausreichende orale Hygiene achten. Eine laufende Bisphosphonattherapie sollte etwa 3 Monate vor einer geplanten Zahnextraktion/Wurzelbehandlung beendet werden.
Literatur
- Poxleitner P. et al., Dtsch Ärztebl Int 2017, 114(5), S. 63–69.
10 Medikamenteninduziertes Fieber
Das Auftreten von Fieber im Rahmen von Leukozytopenien und Neutropenien ist bereits im Abschnitt Hämatologische Toxizitäten besprochen worden.
10.1 Ursache
Auch die Behandlung mit bestimmten Medikamenten wie Cytosinarabinosid, Gemcitabin, Interferon, Interleukin-2 und Pentostatin kann sogenannte Zytokinsyndrome induzieren. Diese gehen mit hohem Fieber und Schüttelfrost bei normaler Leukozytenzahl einher, außerdem kann es zu toxischen Erythemen kommen.
Pathophysiologischer Grundmechanismus ist die Freisetzung bestimmter Mediatoren (Botenstoffe) durch die zytostatische Chemotherapie oder durch eine Immuntherapie. Meistens ist das Auftreten eines Zytokinsyndroms zeitlich eng mit der Gabe des entsprechenden Zytostatikums assoziiert, sodass die Diagnose leicht zu stellen ist. Besondere Bedeutung kommt der Zytokin-Freisetzung derzeit im Rahmen von CAR-T Therapien zu und stellt eine Hauptnebenwirkung dar. Hier wird es meist als CRS (Cytokin-Release Syndrome) bezeichnet.
10.2 Therapeutische Interventionen
Therapeutisch stehen fiebersenkende Maßnahmen im Vordergrund. Zur Kupierung eines Schüttelfrostanfalles eignet sich Piretramid (Handelsname Dipidolor). Auch Steroide können hilfreich sein. Insbesondere zur Prophylaxe eines Zytokinsyndroms bei Applikation von Bleomycin, Gemcitabin oder Mitomycin eignen sich Prednison oder Dexamethason.
Neben diesen supportiven Maßnahmen sollte immer eine Blutkultur im Rahmen der Umfelddiagnostik zur Erregersicherung erfolgen. Im Einzelfall kann es schwer sein, Fieber und Schüttelfrost bei einem Infekt, bei einem Zytokinsyndrom oder bei einer allergischen Reaktion zu unterscheiden.
Von Zytokinsyndromen abzugrenzen ist das sogenannte „Red-Man-Syndrom“. Darunter versteht man ein Erythem nahezu des gesamten Körpers bei zu schneller Infusion des Antibiotikums Vancomycin.
11 Nebenwirkungen einer Kortikosteroidbehandlung
In der antineoplastischen Therapie werden Glukokortikosteroide (Prednison, Dexamethason etc.) häufig eingesetzt. Sie dienen dabei als Antiemetika in Kombination mit Serotoninantagonisten, andererseits zeigen sie zytotoxisches Potenzial bei Leukämien und Lymphomerkrankungen. Je nach Indikation und Dauer der Anwendung findet man ein unterschiedliches Nebenwirkungsspektrum.
Bei Einsatz der Steroide zur antiemetischen Begleittherapie beklagen die Patienten häufig eine Rötung des Kopfes, verbunden mit einem Hitzegefühl. Auch bei nur kurzfristiger Anwendung können Unruhe und Schlafstörungen auftreten. Diese Nebenwirkungen sind passagerer Natur und bedürfen keiner speziellen Behandlung.
Therapeutisch stehen neben einer Minimierung der Steroiddosis lediglich symptomatische Maßnahmen zur Verfügung.
11.1 Hautveränderungen
Auch bei nur kurzzeitiger Anwendung von Steroiden kann es zu Hautveränderungen kommen, insbesondere zu einer Steroidakne. Diese tritt besonders im Gesicht, thorakal und an den Oberarmen auf. Bis auf eine psychische Belastung einiger Patienten kommt der Steroidakne kein Krankheitswert zu.
Die Behandlung erfolgt mit Lokaltherapeutika wie Benzylperoxid oder schwefelhaltigen Verbindungen, die zur Austrocknung der infizierten Follikel führen. Auch Erythromycin kann eingesetzt werden. Bei Absetzen des Steroids ist die Steroidakne schnell rückläufig.
Seltene Nebenwirkungen bei längerfristiger Steroidanwendung sind eine Pergamenthaut und Hirsutismus.
11.2 Störungen im Glukosestoffwechsel
Darüber hinaus kann es bei kurzfristiger Applikation von Steroiden (zirka 1–10 Tage) zu Störungen im Glukosestoffwechsel kommen, mit Hyperglykämie, die klinisch meistens asymptomatisch verläuft und durch routinemäßige Kontrollen des Blutzuckerspiegels festgestellt wird. In seltenen Fällen entwickelt sich eine Trias aus Glukosurie, Polyurie und Polydipsie. Besonders ausgeprägt sind Störungen des Glukosestoffwechsels bei Patienten mit bereits bestehendem Diabetes mellitus.
Therapeutisch ist es das Ziel, die Hyperglykämie zu kontrollieren; eine Diabetesneueinstellung ist bei kurzfristiger Steroidapplikation nicht indiziert. Es gilt, ein Coma diabeticum zu verhindern, wozu sich Subkutaninjektionen von Altinsulin eignen.
Eine längerfristige Steroidapplikation ist bei bestimmten Erkrankungen erforderlich, z. B. bei autoimmunhämolytischer Anämie, Morbus Werlhof, chronischer lymphatischer Leukämie oder anderen niedrigmalignen Non-Hodgkin-Lymphomen. Auch Patienten nach Knochenmarktransplantation werden mit einem Steroid dauerhaft behandelt. Hier gelten für die Behandlung eines neu auftretenden oder eines sich verschlechternden, bestehenden Diabetes mellitus andere Grundregeln. Eine Diabeteseinstellung bzw. -neueinstellung ist erforderlich. Meist erfolgen diese Einstellungen über Misch- und Verzögerungsinsuline (z. B. Actraphane®). Blutzuckerspitzen werden auch hier mit Altinsulin behandelt. Es sind intensive Blutzuckerkontrollen erforderlich und die Insulinmedikation ist je nach Stoffwechselsituation der Höhe der Steroiddosis anzupassen.
Da es sich um palliativ behandelte Patienten handelt, ist auch hier die Komaprophylaxe das erste therapeutische Ziel. In jedem Fall sind Hypoglykämien durch zu intensive Insulingaben zu vermeiden.
Merke: Die Hyperglykämie äußert sich durch eine Glukosurie, Polyurie und Polydipsie sowie bei ausgeprägteren Formen durch eine vertiefte Atmung (Kussmaul- oder Azidose-Atmung). Die Hypoglykämie äußert sich durch Schweißausbrüche, Tremor und ein Heißhungergefühl. Bei Nichterkennen können beide Zustände in ein Koma münden.
Die Hypoglykämie gilt als die für den Patienten gefährlichere Stoffwechselentgleisung.
11.3 Hypertonie
Pathophysiologischer Mechanismus der Hypertonieentwicklung ist die Aldosteronrestwirkung der Glukokortikoide, die eine Resorption von Natrium und Sekretion vom Kalium am distalen Nierentubulus bewirkt. Konsekutiv resultiert aus der Natriumresorption eine vermehrte Wasserretention, sodass ein erhöhtes intravasales Volumen besteht, das direkt die Hypertonie (Volumenhochdruck) bedingt.
Eine sekundäre steroidinduzierte Hypertonie ist mit entsprechenden Antihypertensiva zu behandeln.
11.4 Osteoporose
Pathophysiologischer Mechanismus der Osteoporose-Entwicklung ist die vermehrte Auslösung von Calcium aus den Knochen durch die Steroide. Gleichzeitig wird die renale Calciumelimination gefördert und die enterale Calciumresorption gehemmt, sodass letztendlich im Serum eine Hypokalzämie (siehe dort) resultiert.
Bei längerfristiger Kortikoidtherapie sollte eine Osteoporose-Prophylaxe mit Vitamin D und Calcium erfolgen, bei bestehender Osteoporose sind Bisphosphonate geeignete Therapeutika.
11.5 Veränderungen im Protein- und Fettstoffwechsel
Weitere Langzeitnebenwirkungen einer Steroidtherapie ist das Auftreten eines Proteinkatabolismus mit Muskelatrophie. Da Steroide Hyperlipidämien induzieren und bei Langzeittherapie eine Fettumverteilung erfolgt, ist klinisch ein cushingoides Bild mit Mondgesicht, Stiernacken und Stammfettsucht zu beobachten. In Maximalvarianten treten am Abdomen Striae distensae auf.
11.6 Leukozytose
Die Nebenwirkung auf das hämatopoetische und lymphatische System ist eine Leukozytose mit gleichzeitiger Verminderung der Eosinophilen- und Lymphozytenzahlen. Es wird die Aktivität von B- und T-Lymphozyten vermindert. Die Folge dieser immunsuppressiven Wirkung ist eine erhöhte Infektanfälligkeit. Darüber hinaus wird die Anzahl an Erythrozyten und Thrombozyten vermehrt, wodurch das Thromboserisiko ansteigt.
11.7 Weitere Nebenwirkungen
Außerdem können Ulzera im Magen-Darm-Trakt induziert werden. Bei Verletzungen ist mit Wundheilungsstörungen zu rechnen. Zur Vermeidung gastrointestinaler Ulzera ist eine Säurehemmung mittels H2-Blockern oder Protonenpumpenhemmern indiziert.
Weitere seltene Nebenwirkungen bei längerfristiger Steroidanwendung sind eine Steroid-myopathie (betrifft besonders proximale Extremitäten, wie Schulter- und Beckengürtelmuskulatur), psychische Störungen im Sinne von Psychosen und Dysphorie sowie subkapsuläre Katarakte und Engwinkelglaukome.
Merke: Eine längerfristige Steroidtherapie (länger als 3 Wochen) darf nicht abrupt beendet werden, weil daraus eine Kreislaufinsuffizienz resultieren kann. Es liegt eine Störung des adrenokortikotropen Regelkreises zugrunde, bei dem durch erhöhte Steroidgaben die Hormonproduktion der Nebennieren minimiert wird.
Bei plötzlichem Absetzen des Kortikoids kommt es zu den Symptomen eines Morbus Addison. Daher muss jede längerfristige Steroidtherapie ausgeschlichen werden!
12 Neurotoxizität
Unter einer zytostatikainduzierten Neurotoxizität versteht man eine Schädigung des peripheren und/oder zentralen Nervensystems.
12.1 Ursache
Je nach klinischem Bild liegt ein unterschiedlicher pathophysiologischer Schädigungsmechanismus zugrunde. So kommt es bei der peripheren Polyneuropathie durch Vinca-Alkaloide, wie Vincristin, Vindesin oder Vinblastin, zu einer axonalen Degeneration, während eine cisplatinhaltige Chemotherapie an peripheren Nerven Demyelinisierungen hervorruft. Dadurch werden die Reizweiterleitung und auch die Reizverarbeitung der Nervenzellen erheblich gestört.
Im Gegensatz dazu werden akute und chronische Enzephalopathien dadurch ausgelöst, dass einige Zytostatika die Blut-Hirn-Schranke überwinden können. Daraus folgt, dass Enzephalopathien unter oder kurz nach der Zytostatikainfusion auftreten, während das klinische Verhalten einer peripheren Polyneuropathie nicht berechenbar ist.
Deshalb können Polyneuropathien nach Cisplatin- und Oxaliplatintherapien noch mehrere Monate nach Therapieende auftreten. Zytostatika, die häufig zu peripheren Polyneuropathien und autonomen Neuropathien führen, sind die bereits erwähnten Vinca-Alkaloide, Cisplatin, Methotrexat sowie Paclitaxel und Docetaxel.
Enzephalopathien treten insbesondere bei Therapie mit hochdosiertem oder intrathekal verabreichtem Methotrexat auf. Daneben auch im Rahmen zytostatischer Chemotherapien mit 5-FU, Procarbazin, Cytosinarabinosid, Fludarabin und Ifosfamid.
Von besonderer klinischer Relevanz ist dabei die Ifosfamid-Psychose. Dabei schildern die Patienten unter der Therapie mit höher dosiertem Ifosfamid Wahnvorstellungen und Störungen des Farbsehens. Geeignete Gegenmaßnahmen sind die Therapie mit Methylenblau (definierter Wirkmechanismus) und probatorisch auch mit Piracetam (Nootrop®).
Störungen im Sekretionsverhalten von Hormonen sind nach Gabe von Vinca-Alkaloiden und Cyclophosphamid beschrieben. Hier kann das SIADH-Syndrom ausgelöst werden. Dabei handelt es sich um das Syndrom einer inadäquaten ADH-Sekretion. Klinisch kommt es zur ausgeprägten Hyponatriämie ohne Ödembildung (siehe Teil Komplikationen Abschnitt Paraneoplastische Erkrankungen).
12.2 Symptome
Von peripherer Polyneuropathie spricht man, wenn Kribbelparästhesien oder Dysästhesien bis hin zu Schmerzempfindungen in Händen und Füßen vorliegen (also an den Extremitäten). Bei Schädigungen des autonomen Nervensystems, z. B. im Bereich des Magen-Darm-Traktes, spricht man von autonomer Neuropathie.
Kommt es durch die zytostatische Chemotherapie zu komatösen Zuständen, Vigilanzverschlechterung oder halluzinatorischen Episoden, so liegt eine akute oder chronische Enzephalopathie vor. In seltenen Fällen kann es auch zu zerebellären Dysfunktionen, Schädigungen von Hirnnerven, Myopathien und zu Störungen im hormonellen Sekretionsverhalten kommen.
12.3 Therapeutische/Pflegerische Maßnahmen
Gesicherte Behandlungsoptionen bei der Therapie einer peripheren Polyneuropathie bestehen nicht. Die Datenlage zu simultaner Infusion von Calcium- und Magnesiumverbindungen ist nicht einheitlich. Eine mögliche positive Wirkung auf die Polyneuropathie ist beschrieben, ein Wirkungsverlust von Oxaliplatin jedoch nicht sicher ausgeschlossen. Probatorisch kann hier mit Vitamin-B-Komplex-Präparaten, Magnesium oder mit alpha-Liponsäure (Thioctacid®) gearbeitet werden. Bei schmerzhaften Polyneuropathien von dumpfem Charakter ist eine Behandlung mit Gabapentin (Neurontin®) indiziert, bei einschießendem lanzierenden Charakter mit Pregabalin (Handelsname Lyrica). Meist ist jedoch der Spontanverlauf kaum zu beeinflussen. Als Maximalvariante peripherer Polyneuropathien sind sogar Lähmungserscheinungen beschrieben.
Jede Differenzialdiagnose einer zytostatikainduzierten Neuropathie ist schwierig, da verschiedene Faktoren ausgeschlossen werden müssen. Dazu gehören beispielsweise Einklemmungen von Nervenwurzeln durch den Primärtumor, Metastasierungen im zentralen oder peripheren Nervensystem, eine Meningeosis carcinomatosa (Tumorinvasion in die Hirnhäute), Elektrolytstörungen, metabolische Störungen und auch Tumorembolien und zerebrale Infarkte. Auch bestimmte Antibiotika, wie Penicillin, können Krankheitsbilder auslösen, die den zytostatikainduzierten Neuropathien gleichen. Mit speziellen Fragenbögen (z. B. Polyneuropathie Mini Examination) kann man die sensorischen und motorischen Störungen erfassen. Dabei ist vor allem zu beachten, dass es für Patienten mitunter sehr schwer ist, die Empfindungen zu beschreiben.
Bei sensorischen oder motorischen Störungen sollte das Pflegepersonal den Patienten umfassend beraten und Interventionen aufzeigen, die die Auswirkungen der Polyneuropathie entsprechend abmildern und dem Patienten helfen, seine alltäglichen Aktivitäten möglichst selbstständig durchführen zu können. Diese Interventionen können u. a. sein:
- Hilfe beim An- und Auskleiden
- einfache und sichere Lösungen vorschlagen wie Klett- und Reißverschluss
- Körperhygiene erleichtern durch elektrische Zahnbürste, Verlängerungsstück für Kamm, Lippenstifthalter
- leichtes Geschirr, Tassen mit greifbaren Henkeln, eventuell Trinkhalme benutzen
- bei Haus- und Schreibarbeiten bei Bedarf Hilfsmittel oder Geräte unter Einbeziehung von Physio- und Egotherapie nutzen bzw. zugänglich machen
- Augen-Hand-Kontakt trainieren
- Wohnung auf Gefahrenstellen inspizieren (lassen)
- Schuhe nur mit rutschfesten Sohlen
12.4 Pflegerische Maßnahmen aus dem komplementärmedizinischen Bereich
Das Trainieren der Sensitivität insbesondere an Händen und Füßen kann durch Greifen und Tasten verschiedener Materialien, wie z. B. Sand, getrocknete Hülsenfrüchte oder das künstlerische Arbeiten mit Ton, unterstützt werden. Hilfreich kann auch ein Fußmassagegerät mit Rollen aus Holz oder Kunststoff sein, das regelmäßig im Alltag verwendet werden kann.
Zur Linderung von Parästhesien kann die regelmäßige Selbstmassage mittels einer Wanne mit kleinen Kieselsteinen, in der die Hände und/oder Füße bewegt werden, dienen. Ebenso können temperierte Hand- und Fußbäder eingesetzt werden.
Anschließend bieten sich Einreibungen mit Ringelblumensalbe, Aconit-Schmerzöl® oder einem Moorextrakt an. 1- bis 2-mal wöchentlich kann ein Peeling zur Linderung der Beschwerden angewendet werden. Dazu werden je ein Esslöffel Olivenöl und Zucker auf der Haut einige Minuten verrieben und anschließend mit lauwarmem Wasser abgewaschen; auch Salz-Öl-Peelings sind möglich.
Literatur
- Bühring, U. (2008) Praxis-Lehrbuch der modernen Heilpflanzenkunde, MVS, Stuttgart
13 Pulmonale Toxizität
Prinzipiell sind vier häufige pulmonale Toxizitäten unter zytostatischer Chemotherapie zu unterscheiden:
- die chronische Pneumonitis mit Lungenfibrose
- die Hypersensitivitätspneumonitis
- das nicht kardiale Lungenödem
- die medikamentös induzierte interstitielle Lungenerkrankung
Darüber hinaus existieren seltenere pulmonale Manifestationen, wie ARDS-ähnliche Krankheitsbilder, eine Bronchiolitis obliterans oder sogar die Pulmonalvenen-Verschlusskrankheit (venous occlusive disease).
Häufigste Manifestation ist die zytostatikainduzierte chronische Pneumonitis mit konsekutiver Lungenfibrose. Diese Toxizität ist prinzipiell bei allen Zytostatika möglich – für Antimetaboliten ungewöhnlich – und tritt besonders häufig nach zytostatischer Chemotherapie mit Bleomycin und Alkylanzien (insbesondere Cyclophosphamid) auf.
13.1 Ursache
Als pathophysiologischer Mechanismus der Bleomycin-Lungentoxizität gilt eine Bleomycin-Akkumulation im Lungengewebe durch verminderte Hydrolysierung des Medikamentes. Daneben wird eine vermehrte Sauerstoffradikalbildung und eine Störung des Verhältnisses der T-Helfer- und T-Suppressor-Zellen diskutiert.
Bleomycin-Toxizitäten treten erst Wochen bis Monate nach Therapieende auf, mit einer Inzidenz bis zu 20 %. Die Wahrscheinlichkeit einer Bleomycin induzierten Lungenfibrose nimmt mit dem Alter zu. Auch eine kumulative Bleomycin-Gesamtdosis über 400 mg absolut und eine simultane Bestrahlung von Lungenparenchym gelten als Risikofaktoren für die Entwicklung der Bleomycin-Lungenfibrose.
Merke: Die Bleomycin-Pneumopathie kann durch Gabe von reinem Sauerstoff ausgelöst bzw. verschlimmert werden. Auch Jahre nach Abschluss einer Bleomycintherapie dürfen diese Patienten nicht mit reinem Sauerstoff beatmet werden (beispielsweise im Rahmen operativer Eingriffe)!
13.2 Symptome
Klinisch beginnt die Bleomycin-Pneumonitis schleichend; mit Belastungsdyspnoe, unproduktivem Husten sowie unspezifischen grippalen Allgemeinsymptomen. Bei der Lungenfunktionsprüfung fällt eine Verminderung der Diffusionskapazität auf.
13.3 Diagnostik
Wichtige klinische Hinweise ergeben das Röntgen-Thorax-Bild und das Thorax-CT. Die histologische Sicherung ist im Rahmen einer Bronchoskopie mit broncho-alveolärer Lavage oder transbronchialer Biopsie möglich.
Therapeutisch ist die Bleomycin-Behandlung zu beenden. Die Erkrankung spricht gut auf Steroide an, fulminante Verläufe sind selten.
Die Hypersensitivitätspneumonitis gleicht dem klinischen Bild der exogen-allergischen Alveolitis. Bei der Auslösung dieser pulmonalen Toxizität kommt insbesondere den Zytostatika Bleomycin, Methotrexat und Procarbazin besondere Bedeutung zu.
Das nicht kardiale Lungenödem kann klinisch nicht vom kardialen Lungenödem unterschieden werden. Es tritt häufig nach intravenöser Chemotherapie mit Teniposid oder Cytosinarabinosid auf oder unter oraler Cyclophosphamid- oder Methotrexat-Therapie bzw. auch nach intrathekaler Methotrexat-Applikation. Die Symptomatik entspricht dem kardial bedingten Lungenödem mit Dyspnoe und grobblasigen Rasselgeräuschen. Das Thorax-Röntgen-Bild zeigt typische Stauungszeichen. Die Echokardiografie zeigt jedoch eine normale Ejektionsfraktion – im Gegensatz zum kardialen Lungenödem.
13.4 Medikamentös induzierte interstitielle Lungenerkrankung DI-ILD (Drug Induced Interstitial Lung Disease)
Jürgen Barth
Die arzneimittelinduzierte interstitielle Lungenerkrankung, neudeutsch Drug Induced Interstitial Lung Disease (DI-ILD), kann durch unterschiedliche Medikamente ausgelöst werden. Häufig wird sie erst nach der Zulassung neuer Wirkstoffe offensichtlich, da sie im Rahmen von Zulassungsstudien zu selten ist oder als solche nicht erkannt wird. Die häufigsten auslösenden Medikamentenklassen sind Tumortherapeutika, gefolgt von Wirkstoffen aus der Rheumatologie und Antibiotika. Auch die sog. „Amiodaronlunge“ ist nichts anderes als eine DI-ILD. Leider ist das Wording in den Fachinformationen uneinheitlich. So finden sich Bezeichnungen wie:
- interstitielle Lungenerkrankung
- interstitielle Pneumonitis
- nicht-infektiöse Lungenentzündung
- abakterielle/avirale Lungenentzündung
Selbst die US-Gesundheitsbehörde FDA spricht in ihrer Warnmitteilung im September 2019 für die CDK-4/6-Inhibitoren zur Behandlung von Brustkrebs (Palbociclib, Ribociclib und Abemaciclib) von einer seltenen, aber schwerwiegenden Lungenentzündung, ohne das als ILD zu bezeichnen [https://www.fda.gov/safety/medical-product-safety-information/ibrance-palbociclib-kisqali-ribociclib-and-verzenio-abemaciclib-drug-safety-communication-due-rare]. DI-ILD ist gemäß der American Thoracic Society/European Respiratory Society (ATS/ERS) ein anerkannter Subtyp diffuser Lungenerkrankungen. Klinische, pathologische und radiologische Charakteristika sind selten spezifisch und daher schwierig von anderen interstitiellen Pneumonien abzugrenzen. Darüber hinaus variiert der klinische Phänotyp, die Bildgebung und die histologischen Muster der Einzelsubstanzen, aber auch zwischen den einzelnen betroffenen Patienten mit identischer Medikation. In der Konsequenz basiert die Diagnose einer DI-ILD auf dem Ausschluss anderer Ursachen, was eine besondere Herausforderung für den behandelnden Arzt darstellt.
Eine DI-ILD wird demnach durch die Klinik, die pathologischen und radiologischen Befunde, die mit einer ILD vereinbar sind, gestellt. Dazu gehört der zeitliche Zusammenhang zwischen Therapie- und Symptombeginn, Ausschluss anderer Ursachen wie Infektionen, pulmonale Ödeme, Bestrahlungspneumonitis, Progress der zu Grunde liegenden (Lungen-)Krebserkrankung bzw. der Lungenmetastasen von Tumoren sowie Besserung nach Absetzen des verdächtigen, auslösenden Medikaments, mit oder ohne Kortisontherapie. Arzneistoffe und Erkrankungsmuster sind in der internationalen Datenbank „Pneumotox“ (www.pneumotox.com) katalogisiert. Allerdings gibt es keine Übersicht über Inzidenz, Phänotyp und typischen Verlauf eine DI-ILD. Risikofaktoren für eine DI-ILD können sowohl eine hohe Absolutdosis, als auch die kumulative Gesamtdosis sein, wie beispielsweise unter oraler Dauermedikation.
13.4.1 Symptome
Die Beschwerden einer DI-ILD setzen meist allmählich ein. Bei den meisten Personen tritt Atemnot auf. Des Weiteren sind sie bei körperlicher Betätigung zunehmend eingeschränkt. Zusätzliche Symptome sind hartnäckiger, trockener Reizhusten. Im fortgeschrittenen Stadium kann sich auch eine bläuliche oder violette Verfärbung der Lippen, Hände und Füße, im Sinne einer Zyanose, sowie ein Anschwellen der Finger zeigen. Eine Verschlechterung der Symptomatik kann sehr schnell erfolgen. Fatale Verläufen sind hinlänglich bekannt. So trat während der Entwicklung des Antikörperkonjugats Trastuzumab Deruxtecan (T-DXd) im Rahmen der Zulassungsstudien bei 3 % der Patientinnen eine ILD auf. Von diesen 3 % sind 2,6 % verstorben [EPAR Trastuzumab Deruxtecan]. Mit ein Grund war sicherlich die Unkenntnis seinerzeit, dass T-DXd eine ILD auslösen kann. Zögerliches Handeln und/oder eine nicht korrekte Diagnose resultierte dann in fatalen Verläufen.
13.4.2 Diagnose
Wie schon beschrieben, basiert die Feststellung einer ILD auf Ausschlussdiagnosen. Kombiniert werden die hochauflösende Computertomografie in Dünnschichttechnik (high-resolution CT, HRCT) mit invasiven Maßnahmen wie Bronchoskopie mit bronchoalveolärer Lavage (BAL), transbronchiale Zangenbiopsien oder transbronchiale Kryobiopsie. Differenzialdiagnostische Hinweise finden sich im Konsensuspapier der S1-Leitlinie Interdisziplinäre Diagnostik interstitieller Lungenerkrankungen im Erwachsenenalter.
13.4.3 Therapeutische Maßnahmen
Bereits bei Verdacht auf eine DI-ILD wird das suspekte Medikament abgesetzt und zeitnah die weiterführende Diagnostik eingeleitet. Medikamentös kommen meist Glukokortikoide zum Einsatz, eine supportive Sauerstoffbeatmung kann notwendig sein.
13.4.4 Arbeitshilfe für die Praxis
Auf die Datenbank „Pneumotox“ zur Identifizierung eines DI-ILD auslösenden Medikament wurde bereits hingewiesen. Die folgende Tabelle weist moderne orale Tumortherapeutika aus, für die eine DI-ILD beschrieben ist. Wenn Sie also einen Patienten betreuen, der eines dieser Medikamente einnimmt und hustet:
- Testen Sie sich auf COVID.
- Sollte der Test negativ sein, raten Sie nicht zur Selbstmedikation oder zu empirischen Antibiotika.
- Informieren Sie den behandelnden Onkologen.
Merke: Hustet ein Patient unter der Einnahme der in der Tabelle gelisteten oralen Tumortherapeutika, muss schnellstens eine DI-ILD Ausschlussdiagnostik erfolgen.
Moderne orale Tumortherapeutika die eine DI-ILD verursachen können. Die mit * gekennzeichneten Substanzen werden gegen Lungentumore eingesetzt, was die ILD-Diagnostik nicht leichter macht. Ein Progress des Tumors muss dann auch ausgeschlossen werden.
| Abemaciclib |
| Adagrasib* |
| Afatinib* |
| Alectinib* |
| Alpelisib |
| Binimetinib |
| Brigatinib* |
| Capmatinib* |
| Ceretinib* |
| Cobimetinib |
| Crizotinib* |
| Dabrafenib* |
| Dasatinib |
| Dacomitinib |
| Erlotinib* |
| Everolimus |
| Gefitinib* |
| Gilteritinib (?) |
| Ibrutinib |
| Idelalisib |
| Lapatinib |
| Lorlatinib |
| Midostaurin |
| Mobocertinib* |
| Olaparib (?)# |
| Osimertinib* |
| Palbociclib |
| Pemigatinib* |
| Pralsetinib |
| Reprotrectinib* |
| Ribociclib |
| Sotorasib* |
| Tepotinib* |
| Trametinib* |
| Vandetanib |
| # Kein konsistentes klinisches Muster; wurden überlagert von einer Reihe anderer prädisponierender Faktoren: – Krebs und/oder Metastasen in der Lunge, – zugrunde liegende Lungenerkrankung, – Rauchen in der Vorgeschichte und/oder – vorherige Chemotherapie und Strahlentherapie. |
13.5 Therapie
Unter Steroidbehandlung kommt es zur zügigen Abheilung der Hypersensitivitätspneumonitis. Auch bei einer Lungenfibrose ist die Steroidtherapie Maßnahme der Wahl. Die Therapie des akuten chemotherapeutisch induzierten Lungenödems besteht – wie beim kardialen Lungenödem – aus Gabe von Nitraten und Diuretika.
Die Pneumonitis nach immunonkologischen Therapien ist im Abschnitt Nebenwirkungen immunonkologischer Therapien beschrieben.
14 Renale Toxizität
Zytostatikatherapien können zur Entwicklung einer Niereninsuffizienz führen.
14.1 Ursache
Als pathophysiologischer Mechanismus liegt eine Schädigung in den verschiedenen Abschnitten des Nephrons oder auch des renalen Interstitiums zugrunde. Am häufigsten sind die Schäden im Tubulussystem. Darüber hinaus können bestimmte Zytostatika im Rahmen metabolischer Veränderungen im Tubulussystem auskristallisieren und ein akutes Nierenversagen bedingen.
Typischerweise tritt eine renale Toxizität bei Behandlung mit Cis- oder Carboplatin, Carmustin, Cyclo- oder Ifosfamid auf. Methotrexat gilt ebenfalls als nephrotoxisches Medikament. Dabei bedingen die Platinverbindungen tubulointerstitielle Nephropathien in Verbindung mit irreversiblen Tubulusnekrosen, Carmustin induziert vorrangig glomeruläre Läsionen. Über die Auskristallisation im Tubulusapparat hinaus kann Methotrexat Tubulusnekrosen mit konsekutiver Niereninsuffizienz auslösen.
14.2 Symptome
Neben der klassischen Nephrotoxizität können Zytostatika wie Cyclophosphamid und Ifosfamid eine hämorrhagische Zystitis induzieren. Diese äußert sich klinisch in einer schmerzhaften Makrohämaturie. Sichere Prophylaxe sind begleitende Applikationen von Mesna.
Neben den direkten, durch Zytostatika bedingten Nierenschädigungen kann auch der Tumorzellzerfall bei Einleitung der zytostatischen Chemotherapie durch vermehrten Anfall von Harnsäure zum akuten Nierenversagen führen (Uratnephropathie). Dieser massive Zelluntergang geht einher mit Hyperkaliämie, Hyperphosphatämie, Hypokalzämie und Hyperurikämie. Man spricht von einem Tumorlysesyndrom (siehe Abschnitt Tumorlysesyndrom).
14.3 Diagnostik
Die Diagnose wird klinisch und laborchemisch gestellt.
14.4 Therapeutische/Pflegerische Maßnahmen
Als prophylaktische Maßnahme zur Prävention der renalen Toxizität sind ausgiebige Hydratationen mit Ersatz von Elektrolyten wie Kalium und Magnesium etabliert. Diese sind bei Cisplatintherapie zwingend erforderlich. Die Menge an Spülflüssigkeit sollte mindestens 2000 ml (1000 ml vor, 1000 ml nach der Platininfusion) enthalten. Auch die Gabe von 40 mg Furosemid direkt vor der Platinapplikation kann das nephrotoxische Potenzial durch beschleunigte renale Elimination des Medikamentes senken. Zur Reduktion der Nephrotoxizität haben weiterhin modernere Platinverbindungen wie Carboplatin oder Oxaliplatin beigetragen. Bei diesen Medikamenten ist eine begleitende Hydratation nicht zwingend erforderlich. Auch die Prävention der Methotrexat induzierten Nephrotoxizität umfasst ausgiebige Flüssigkeitszufuhr sowie darüber hinaus ein Alkalisieren des Harns mit Einstellen des Urin-pH-Wertes über 7 (Kontrolle via Teststreifen).
Die Aufgaben des Pflegepersonals konzentrieren sich meist auf eine exakte Ein- und Ausfuhrbilanzierung.
15 Toxizität von Haut und Hautanhangsgebilden
15.1 Akne/Rash
Seit Einführung molekularer Therapeutika (Anti-EGFR-Therapien, Anti-VEGF-Therapien u. ä.) beobachtet man eine neue Form kutaner Toxizität, die als aknoide Reaktion in Verbund mit Hautrötung auftritt. Diese wird als Rash bezeichnet.
15.1.1 Ursache
Der zugrunde liegende pathophysiologische Mechanismus ist nicht vollständig geklärt. Der EGF-Rezeptor in der Epidermis ist jedoch von Bedeutung zur Sicherung der Homöostase und „Stabilität“ der Zellen im Stratum basale der Epidermis. Der kutane EGF-Rezeptor ist wichtig für die Funktion der sog. „Tight-Junctions“. Das sind adhäsive Proteine bzw. Verbindungsproteine zwischen den Basalzellen (Keratinozyten), die den interzellulären Kontakt sicherstellen und aufrechterhalten. Das kutane EGFR Targeting induziert einen Wachstumsarrest dieser basalen Keratinozyten und eine „Störung“ der Tight-Junctions mit Verlust der interzellulären Kontakte sowie darüber hinaus die Freisetzung proinflammatorischer Zytokine. Weiterhin wird die Sekretion antibakterieller Peptide reduziert [1, 2].
15.1.2 Symptome
Die Hautveränderungen erinnern initial an akneähnliche Veränderungen, wie sie aus der Jugend bekannt sind. Es finden sich papulöse Effloreszenzen auf gerötetem Untergrund. Dies ist weder schmerzhaft noch tritt ein Juckreiz auf. Die Veränderungen betreffen sowohl Gesicht als auch Körperstamm und Extremitäten. Superinfektionen sind möglich (exsudative Phase). Im Verlauf mehrerer Monate kommt es dann zu einem Austrocken der Haut (xerotische Phase). Dabei wird die Haut derb und rissig (Hautatrophie). Speziell Tyrosinkinase-Inhibitoren können zu schmerzhaften Rissbildungen an den Händen führen, sog. Skin-Cracking.
15.1.3 Therapie
Prophylaktisch sollten ab Therapiebeginn zweimal täglich pflegende Externa angewendet werden, wie z. B. pH-neutrale Seifen oder Dermowas®. Die Behandlung selbst ähnelt dann der Aknetherapie; so werden antibakterielle Wirkstoffe auf Wasserbasis in der exsudativen Phase verabreicht, z. B. Benzoylperoxid. Auch metronidazolhaltige Salben kommen infrage. In der xerotischen Phase sind fetthaltige oder harnstoffhaltige Externa Mittel der Wahl. Bei schwereren Verläufen sind systemische Antibiotika, z. B. Doxycyclin, indiziert. Systemische Antibiotika haben auch in der Prophylaxe einen gesicherten Stellenwert. So konnte in einer randomisierten Studie eine etwa 50 %-ige Rash-Reduktion unter prophylaktischer Doxycyclingabe gezeigt werden (STEPP-Studie).
15.2 Alopezie
Unter einer Alopezie versteht man den teilweisen oder vollständigen Ausfall des Kopfhaares, bedingt durch die zytostatische Chemotherapie. Darüber hinaus kann es auch zu einem Ausfallen der Barthaare, der Augenbrauen sowie der Achsel- und der Schambehaarung kommen. Klassische Alopezie induzierende Substanzen sind z. B. Doxorubicin und Cyclophosphamid.
15.2.1 Ursache
Pathophysiologische Grundlage der Alopezie ist die Toxizität der angewendeten Zytostatika auf die Haarfollikel. Die Zellen in den Haarfollikeln gehören wie auch die Darmepithelien zu den sich schnell teilenden Körperzellen und reagieren deshalb besonders empfindlich auf die zytostatische Chemotherapie. Eine Alopezie I. und II. Grades beschreibt den teilweisen Ausfall des Kopfhaares, Grad III den reversiblen, jedoch totalen Ausfall. Bei einer Alopezie Grad IV ist der Haarverlust irreversibel.
Insbesondere für weibliche Patienten unter zytostatischer Chemotherapie stellt die Alopezie ein ernstzunehmendes Problem dar. Die Alopezie verstärkt bei Frauen die ohnehin große psychische Belastung durch die zytostatische Chemotherapie. Aus therapeutischer Sicht hingegen stellt die Alopezie eine eher unwesentliche Nebenwirkung dar.
15.2.2 Therapeutische Interventionen
Gesicherte Maßnahmen zur Prävention der Alopezie sind nicht bekannt. Physikalische Maßnahmen, wie Senkung der Kopfhauttemperatur durch Auflegen von Eisbeuteln bzw. Kältekappen, haben sich nicht bewährt. Auch medikamentöse Behandlungsversuche (z. B. Procain®) sind in ihrer Bedeutung nicht gesichert. Im klinischen Alltag sind über 95 % der induzierten Alopezien reversibel.
15.2.3 Pflegerische Maßnahmen
Die frühzeitige und möglichst sachgerechte Information über eine mögliche therapeutisch bedingte Alopezie kann dem Patienten helfen, besser mit dieser belastenden Situation umzugehen. Trotz der sich rasch verändernden Haarmode ist es vor allem immer noch für Patientinnen ein einschneidendes Erlebnis, wenn sie ihre Haare durch die Tumorbehandlung verlieren. Jeder Patient braucht ganz individuell Zeit, um sich und seine Umgebung langsam an das veränderte Äußere zu gewöhnen.
Die pflegerische Betreuung konzentriert sich vor allem auf die Beratung über die Auswirkungen des Haarausfalls und die kosmetischen Möglichkeiten. Die Patienten sollten darüber informiert werden, dass der Haarausfall nach einer Chemotherapie reversibel ist; irreversible Schäden kommen nur bei einer hochdosierten Schädelbestrahlung vor. Die Haare können langsam oder auch büschelweise ausfallen. Das neue, wieder nachwachsende Haar kann sich möglicherweise in der ursprünglichen Farbe und Beschaffenheit unterscheiden. Die kahle Kopfhaut sollte vor Kälte, Hitze und direkter Sonnenbestrahlung geschützt werden. Geeignet dafür sind Perücken, Hüte, Mützen und Kopftücher.
Beim Verlust von Augenwimpern sollten die Augen mit entsprechenden Brillen vor intensivem Licht und vor Staub geschützt werden. Es bestehen kosmetische Möglichkeiten, um dies zu überbrücken.
Wichtig: Vor dem Haarausfall sollte man sich mit der Wahl der Perücke auseinandersetzen, damit der Fachmann die natürlichen Haare noch sehen kann. Fotos können diesen Eindruck nur schlecht vermitteln.
Die Art, wie der Patient mit der Situation umgeht und welche Variante er zur Überbrückung der Zeit des Haarausfalls wählt, hängt wesentlich mit der Einstellung und der Kreativität der Pflegenden und des Arztes zusammen. Bei der Beratung von Patienten ist zu beachten, dass sich gerade jüngere Patienten sowie Männer mit spärlichem Haar oft ohne Perücke wohler fühlen. Auch kann mit kunstvollem Einsatz von Hüten, kleingestrickten Mützen und Tüchern oft ein vorteilhafter optischer Effekt erzielt werden.
Patienten, die sich eine Teil- oder Ganzhaarperücke wünschen, sollten vor allem im Hinblick auf deren Finanzierung oder teilweisen Finanzierung durch die Krankenkassen beraten werden. Inzwischen haben auch Kosmetikfirmen die Bedeutung von Patienten mit Haarausfall erkannt und bieten für diese Gruppe ganz spezielle Schulungen an, z. B. Schminktipps und Workshops zum Thema „Verändertes Körperbild bei Tumorpatienten“.
15.3 Hand-Fuß-Syndrom
Unter einem Hand-Fuß-Syndrom (HFS) versteht man die Rotfärbung der Hände und/oder Füße bis hin zum Ablösen der Haut an den Akren. Man beobachtet das HFS häufig als Komplikation einer Therapie mit infusionsbasiertem 5-FU oder Capecitabin, nicht jedoch bei UFT. Weitere auslösende Zytostatika sind Anthrazykline und Taxane, insbesondere Docetaxel, aber auch Tyrosinkinase-Inhibitoren, z. B. Sorafenib, Sunitinib.
15.3.1 Ursache
Der zugrunde liegende pathophysiologische Mechanismus ist nicht geklärt.
15.3.2 Symptome
Klinisch werden drei Schweregrade unterschieden. Bei Grad I besteht ein Erythem mit dezenter rötlicher Tüpfelung, ohne dass der Patient kompromittiert ist. Bei Grad II nehmen diese Veränderungen zu und es treten zusätzlich Risse im Bereich der Gelenkfalten auf. Die Haut wird jetzt glänzig. Leichte Schmerzen können auftreten, die motorischen und sensiblen Funktionen sind jedoch nicht beeinträchtigt. Bei Grad III kommt es zum Ablösen der Haut und zum Auftreten heftiger Schmerzen mit Funktionseinbußen, sodass ein Faustschluss, Gehen oder Schreiben nicht mehr möglich sind.
15.3.3 Therapeutische/Pflegerische Maßnahmen
Das auslösende Agens wird zunächst pausiert bzw. in seiner Dosis reduziert. Probatorisch können 300 mg Pyridoxin (3 x 100 mg Vitamin B6) verabreicht werden, was durch rückfettende Ölbäder oder auch steroidhaltige Externa ergänzt werden kann. Eine uridinhaltige Creme kann im Falle einer Fluoropyrimidintherapie angewendet werden. Hierbei ist zu beachten, dass der Anteil an Uridin für die Fußpflege höher sein muss als bei der Handcreme, da durch die unterschiedliche Hautbeschaffenheit sonst eine Wirkung nicht garantiert werden kann.
Da eine gesicherte Prophylaxe nicht bekannt ist, ist es wichtig, den Patienten genau zu beobachten und bereits bei erstgradigen Veränderungen eine Behandlung einzuleiten bzw. durch Reduktion der Dosis oder kurze Therapiepausen ein Fortschreiten des HFS zu verhindern.
15.4 Hyperpigmentation
Bei den Pigmentschädigungen der Haut dominiert die Hyperpigmentation; eine Hypopigmentation ist sehr selten. Zu den typischen Substanzen, die eine Hyperpigmentation induzieren können, gehören z. B. Bleomycin, Busulfan, Cyclophosphamid und Thiotepa.
15.4.1 Ursache
Als pathophysiologische Mechanismen gelten eine chemotherapeutisch induzierte Sekretion des adrenokortikotropen Hormons (ACTH) und des melanozytenstimulierenden Hormons (MSH).
15.4.2 Symptome
Durch eine Bleomycin-Behandlung können Sklerosen auch in der Subkutis induziert werden. Dieses Phänomen kann insbesondere durch Kratzeffekte deutlich verstärkt werden.
15.4.3 Therapeutische/Pflegerische Maßnahmen
Insgesamt gesehen handelt es sich bei den Hyperpigmentationen allerdings lediglich um ein kosmetisches Problem. Spätschäden sind in aller Regel nicht zu befürchten, auch wenn manche Hyperpigmentationen zeitlebens irreversibel sind. Es gilt jedoch, Sonnenexposition und Kratzen zu vermeiden.
15.5 Nagelveränderungen
An Finger- und Zehennägeln können durch eine zytostatische Chemotherapie sowohl Wachstumsveränderungen als auch Pigmentanomalien hervorgerufen werden. Die Wachstumsveränderungen äußern sich in einer typischen Querstreifung der Finger- und Zehennägel. Man spricht hier auch von einer Nagelbänderung. Nagelablösungen (Onycholysen) sind seltener.
15.5.1 Ursache
Pathophysiologische Grundlage der Nagelbänderung ist ein durch die Zytostatika induzierter Schaden in den Basalzellen des Nagelfalzes, wo durch die zytostatische Chemotherapie ein kurzfristiger Proliferationsstopp entsteht. Anschließend kommt es zu einer Regeneration und zu einem distalen „Vorschieben“ der durch die zytostatische Chemotherapie beschädigten Zellen. Somit resultiert eine Querstreifung auf dem Nagel. Selten sind Nagelhyperpigmentationen oder sogar Blauverfärbungen der Nägel.
Eine besondere Form der Nageltoxizität kann unter Therapie mit Anti-EGFR-Substanzen auftreten. Dabei beobachtet man unter Therapie mit Antikörpern wie Cetuximab oder Panitumumab periunguale Granulationen, die mit schmerzhaften und zum Teil blutenden Verdickungen an dem Nagelfalz einhergehen. Hier droht Gefahr durch Superinfektionen. In schwerwiegenden Fällen kann es zur Ablösung des kompletten Nagels kommen.
15.5.2 Therapeutische/Pflegerische Maßnahmen
Interventionen sind nicht erforderlich. Die Kosmetikindustrie bietet lichtreaktive Nagellacke an, die die optische Eigenschaft besitzen, gelbliche Verfärbungen der Nägel zu kaschieren (Nagelweißer) und es werden sog. Rillenfüller angeboten, die die Nageloberfläche bei vorhandener Riffelung glätten können. Insbesondere weibliche Patienten können diese bei unverletzter Nagelhaut und Nagelbett verwenden, um ein kosmetisch ansprechendes Ergebnis zu erzielen.
15.6 Photosensitivität
15.6.1 Ursache
Die zytostatikainduzierte Photosensitivität beschreibt eine „Überreaktion“ der Haut gegenüber UV-Bestrahlung (meistens Sonnenlicht), die pathophysiologisch durch die Einlagerung verschiedener Zytostatika in die Zellen der Epidermis bedingt ist. Dadurch werden diese gegenüber UV-Licht sensibilisiert. Unter den zielgerichteten Therapien können insbesondere BRAF-Inhibitoren eine schwere Photosensitivität auslösen.
15.6.2 Symptome
Es resultieren Erytheme, Ödeme und in schwereren Fällen Bläschenbildungen. Von besonderer klinischer Bedeutung ist die Photosensitivität nach Gabe von Bleomycin, Dacarbazin, 5-FU, Mercaptopurin, Methotrexat, Procarbazin und Vinblastin.
15.6.3 Therapeutische/Pflegerische Maßnahmen
Die wesentliche Prophylaxe stellt die Vermeidung intensiver Sonnenexposition dar. Dazu sollten langärmlige Kleidung und Hüte getragen werden. Es sollten Sonnencremes mit Schutzfaktor 50 verwendet werden.
Für immunogene kutane Nebenwirkungen siehe Abschnitt Nebenwirkungen immunonkologischer Therapien.
Literatur
- Lichtenberger et al., Sci Transl Med. 2013, 21:5 (199)
- Lacouture et al., Nat Rev Cancer 2006, 6(10), 803–12
16 Schädigung von Sinnesorganen
Prinzipiell können alle fünf Sinnesqualitäten des Menschen durch eine zytostatische Chemotherapie beeinträchtigt werden. Auf die Schädigung des Tastsinns in Form einer peripheren Polyneuropathie wurde bereits im Abschnitt Neurotoxizität eingegangen. Selten und klinisch nicht relevant sind Schädigungen des Geruchssinns (olfaktorische Schädigungen).
16.1 Ototoxizität
Unter Ototoxizität versteht man die Schädigung des Gehörs durch eine zytostatische Chemotherapie. Typisches Beispiel für die zytostatikainduzierte Ototoxizität ist die Schädigung des Gehörs durch die Substanz Cisplatin. Diese kann sich im Auftreten von Klingelgeräuschen (Tinnitus) oder Abschwächung des Hörvermögens bis hin zur Taubheit äußern.
Pathophysiologisch liegt eine Schädigung des Innenohrs zugrunde. Cisplatin lagert sich in die inneren Haarzellen ein, wodurch Veränderungen oder Abschwächungen der Tonwahrnehmung und auch eine gestörte Übertragung der Impulse aus den inneren Haarzellen auf den Hörnerv (Nervus vestibulocochlearis) resultieren. Meist tritt eine Schädigung erst bei höheren Cisplatindosen kumulativ auf. Der Schaden am Gehör kann sogar erst nach Abschluss der Cisplatinbehandlung manifest werden.
Gesicherte prophylaktische oder therapeutische Maßnahmen sind nicht bekannt, vom Spontanverlauf her ist die cisplatininduzierte Ototoxizität jedoch meist reversibel.
16.2 Gustatorische Schädigungen
Hierunter versteht man die Schädigung der Geschmacksnerven durch eine zytostatische Chemotherapie. Wiederum gilt Cisplatin als der typische Vertreter zur Auslösung einer solchen Schädigung. Unter Cisplatintherapie beklagen Patienten häufig das Gefühl, einen metallischen Geschmack wahrzunehmen, was insbesondere in den Tagen nach der Cisplatininfusion ausgeprägt und ohne besondere Maßnahmen rückläufig ist. Maximalvariante ist der Verlust des Geschmacksempfindens. Geschmackstörungen können durch Zytostatika, die ihrerseits Schleimhautschäden induzieren, z. B. 5-Fluorouracil, verstärkt werden.
Eine kausale Prävention des Metallgeschmacks nach Platintherapie ist nicht bekannt, vielen Patienten hilft jedoch das Lutschen von Pfefferminzbonbons etc. Darüber hinaus ist selbstverständlich eine begleitende Stomatitis entsprechend zu therapieren (siehe Abschnitt Gastrointestinale Toxizität).
16.3 Ophthalmologische Toxizität
Die Schädigung des Auges durch eine zytostatische Chemotherapie wird als ophthalmologische Toxizität bezeichnet. Beispielhaft sei das Medikament Cytosinarabinosid (Ara-C) genannt. Dieses lagert sich in höheren Dosen reversibel in die Kornea ein und bewirkt einen klinischen Symptomenkomplex aus Photophobie und schmerzhaftem Lidschluss.
Eine korneale Schädigung tritt direkt während oder kurz nach der Therapie mit hochdosiertem Cytosinarabinosid auf, z. B. bei der Behandlung von Leukämien oder Lymphomen.
Prophylaktisch und therapeutisch stehen Spülungen im Vordergrund, wobei sowohl kortikoid- als auch natriumchloridhaltige Augentropfen verwendet werden. Darüber hinaus steigert auch die systemische Infusion von Ringer- oder Kochsalzlösung die Clearance des Medikamentes Ara-C im Kammerwasser.
Neben Ara-C können auch z. B. das Anti-Östrogen Tamoxifen oder das Zytokin Interferon-alpha reversible Sehstörungen auslösen; hierfür ist der Mechanismus der Schädigung nicht bekannt. Auch Retinoide, die in der Behandlung von Nierenzellkarzinomen oder der akuten Prolymphozytenleukämie eingesetzt werden, können zu Sehstörungen führen.
Ebenfalls können moderne Antikörper-Wirkstoff-Konjugate wie Belantamab-Mafodotin korneale Nebenwirkungen auslösen. Diese äußern sich zumeist in Form einer Keratopathie oder mikrozystenähnlichen epithelialen Veränderungen (engl. Microcyst-like epithelial changes, MECs) des Hornhautepithels. Derartige Nebenwirkungen sind sehr häufig und traten in klinischen Studien bei über 70 % der Patienten auf.
In den meisten Fällen ist die Diagnose schwierig und erfordert die differenzialdiagnostische Abgrenzung gegenüber anderen primären Augenerkrankungen sowie intraokulären Metastasen.
Die Befunde an der Hornhaut können symptomlos, aber auch als verschwommenes Sehen und Trockenheitsgefühl der Augen (mit oder ohne Verminderung der Sehschärfe) vom Patienten wahrgenommen werden.
Nach heutigem Wissensstand verläuft die Keratopathie durch Neubildung epithelialer Zellen reversibel. Die damit verbundene Symptome gehen vollständig zurück.
Patienten mit Multiplem Myelom, die mit Belantamab-Mafodotin behandelt werden, benötigen sowohl vor Behandlungsbeginn als auch vor den folgenden Behandlungszyklen und je nach klinischer Indikation während der Behandlung, eine ophtalmologische Untersuchung mit Beurteilung der Sehschärfe einschließlich einer Spaltlampenuntersuchung. Außerdem ist die Behandlung mit konservierungsmittelfreiem Tränenersatzmittel 4 x täglich indiziert.
Weitere Informationen können aktuellen Schulungsmaterialien entnommen werden.
17 Thyreotoxizität
Im Rahmen der onkologischen Diagnostik und Therapie kann es zu Funktionsstörungen der Schilddrüse (Hyperthyreose oder Hypothyreose) kommen.
17.1 Ursache
Hyperthyreosen treten in aller Regel als Folge diagnostischer Maßnahmen mit Exposition gegenüber jodhaltigen Kontrastmitteln auf, insbesondere Computertomografien. Hypothyreosen werden vielfach durch zielgerichtete Therapien (Tyrosinkinase-Inhibitoren) ausgelöst, wenn der Tyrosinkinase-Inhibitor zu einer Hemmung der RET-Tyrosinkinase führt. Gut dokumentiert ist dies am Beispiel von Sunitinib.
17.2 Symptome
Symptome einer Hyperthyreose sind beispielsweise Unruhe und Tremor, Tachykardie, Hitzeempfindlichkeit, Durchfälle und Gewichtsabnahme. Bei einer Herzfrequenz über 140/min liegt eine thyreotoxische Krise vor, die als vital bedrohliches Krankheitsbild gilt. Im Gegensatz dazu sind Patienten mit einer Hypothyreose antriebsgemindert und müde (differenzial-diagnostische Abgrenzung zum Fatigue-Syndrom erforderlich), bradykard und obstipiert. Es besteht eine Kälteempfindlichkeit. Es kann zu einer ödematös-teigigen Veränderung der Haut kommen (sog. Myxödem).
17.3 Diagnostik
Die Diagnose erfolgt über die Bestimmung des TSH-Spiegels (Thyroidea stimulierendes Hormon). Bei Hyperthyreose ist der TSH-Spiegel erniedrigt, bei Hypothyreose erhöht. Um eine Hypothyreose unter Therapie mit Tyrosinkinase-Inhibitoren zeitgerecht zu diagnostizieren, wird empfohlen, den TSH-Spiegel alle 3 Monate zu bestimmen.
17.4 Therapie
Eine Hyperthyreose wird mit Thyreostatika wie Carbimazol behandelt, die Hypothyreose durch Substitution der Schilddrüsenhormone (Levothyroxin).
Um das Auftreten einer Hyperthyreose bei Kontrastmittelexposition zu vermeiden, ist bei Patienten mit einer latenten Hyperthyreose die Gabe von Natriumperchlorat prophylaktisch indiziert (Therapiedauer 5–7 Tage).
Die Deskription der immunogenen Thyreotoxizität, die sowohl Hyper- als auch Hypothyreose bedeuten kann, findet sich im Abschnitt Nebenwirkungen immunonkologischer Therapien.
18 Tumorlysesyndrom
Unter einem Tumorlysesyndrom versteht man eine massive Freisetzung intrazellulären Materials in einem kurzen Zeitraum als Folge eines ausgedehnten Tumorzerfalls. Ein Tumorlysesyndrom kann sowohl bei schnell proliferierenden Tumoren mit zentraler Nekrotisierung auftreten als auch Komplikation bei Einleitung einer zytostatischen Chemotherapie bei großer Tumorlast sein.
Unabhängig von seinem Entstehungsmechanismus ist ein Tumorlysesyndrom durch typische metabolische Veränderungen charakterisiert: Hyperurikämie, Hyperphosphatämie, Hyperkaliämie und Hypokalzämie, metabolische Azidose und Nierenfunktionseinschränkungen bis hin zum akuten Nierenversagen. In seltenen Fällen kann eine disseminierte intravasale Gerinnung ausgelöst werden.
18.1 Ursache
Pathophysiologisch kommt es beim Absterben von Tumorzellen zur Permeabilität der Tumorzellmembran für intrazelluläre Substanzen. Die Nukleinsäuren aus dem Zellkern der Tumorzelle werden freigesetzt, wodurch es zur Hyperurikämie mit Auskristallisieren der Harnsäure im Tubulusapparat der Nieren kommt. Man spricht von einer sogenannten Uratnephropathie. Das beim Zelltod freigesetzte Kalium und saure Valenzen führen zur metabolischen Azidose.
Komplikationen können das bereits erwähnte akute Nierenversagen sein oder Herzrhythmusstörungen, in Folge Hyperkaliämie und Hypokalzämie (siehe Teil Komplikationen).
18.2 Symptome
Die klinische Symptomatik eines Tumorlysesyndroms ist variabel und uncharakteristisch. Ein Leitsymptom gibt es nicht. Klinisch können Übelkeit, Tachykardien, Oligurie, Herzrhythmusstörungen, Lethargie, Muskelkrämpfe oder abdominelle Schmerzen und Flankenschmerzen auftreten. Bei Vorliegen einer großen Tumorlast, bei schnell wachsenden Tumoren und einem unklaren klinischen Bild ist an ein Tumorlysesyndrom zu denken. Ein Tumorlysesyndrom kann bei allen Tumorentitäten auftreten, ist jedoch am häufigsten bei Leukämien oder Lymphomen, kommt aber auch bei schnell wachsenden soliden Tumoren vor, wie kleinzelligen Bronchialkarzinomen oder Mammakarzinomen.
18.3 Diagnostik
Die Diagnose ergibt sich über die spezifischen Laborveränderungen (Hyperkaliämie, Hypokalzämie, LDH-Erhöhung, Kreatininerhöhung, Harnsäureerhöhung) bei einem zum Tumorlysesyndrom determinierenden Malignom.
18.4 Therapie
Zu Therapiebeginn gelten eine deutlich erhöhte LDH, eine vorbestehende Hyperurikämie oder eine vorbestehende Niereninsuffizienz bei großer Tumorlast als Risikofaktoren.
In der entsprechenden Konstellation stützt sich die Prophylaxe eines Tumorlysesyndroms auf drei Pfeiler:
- ausgiebige Hydratation (einschließlich Bilanzierung)
- Hemmung der Xanthinoxidase durch Allopurinol (Beginn mindestens 24 Stunden vor Einleitung der Chemotherapie); in kritischen Fällen i.v. Gabe
- Frühzeitige Behandlung mit Rasburicase bei deutlich erhöhten Harnsäurewerten
Diese Basismaßnahmen werden auch in der Therapie des manifesten Tumorlysesyndroms angewendet. Darüber hinaus beinhaltet die Therapie die Senkung eines erhöhten Kaliumspiegels durch beispielsweise Kationenaustauscher (Resonium®), Glukose-Insulin-Infusionen, Bikarbonat-Applikation oder Gabe von Beta-2-Sympathomimetika. Eine Hypokalzämie ist durch Calciumgluconat-Lösungen auszugleichen. Falls eine Senkung der erhöhten Harnsäure binnen Stunden erforderlich ist, z. B. bei Harnsäurewerten über 20 mg/dl, kann das Enzym Rasburicase (Fasturic®) eingesetzt werden, das Harnsäure in Allantoin umwandelt.
Bei konservativ nicht kontrollierbaren metabolischen Entgleisungen sollte frühzeitig die Indikation zur Hämodialyse gestellt werden. Zwingende Indikationen dazu sind ein akutes Nierenversagen mit den klinischen Zeichen der Überwässerung (Lungenödem) oder konservativ nicht zu beherrschende Elektrolytentgleisungen.
18.5 Prognose
Ein Tumorlysesyndrom ist ein lebensbedrohlicher Zustand. Eine unverzügliche Therapie ist stets erforderlich. Unter Einhaltung der prophylaktischen Richtlinien und einer konsequenten Therapie unter Einschluss der Dialysemöglichkeiten ist die Prognose jedoch gut.
19 Übelkeit und Erbrechen (CINE)
Chemotherapieinduzierte Nausea (Übelkeit) und Emesis (Erbrechen) (CINE) stellen für die Patienten eine gefürchtete Nebenwirkung dar. Nach dem klinischen Erscheinungsbild werden
- die akute Emesis,
- die protrahierte (verzögerte) Emesis und
- das antizipatorische Erbrechen unterschieden.
Jede Form von Übelkeit und Erbrechen, die innerhalb der ersten 24 Stunden nach Applikation der Chemotherapie auftritt, wird als akut-toxisches Geschehen definiert.
Jede Form von Übelkeit und Erbrechen, die später als 24 Stunden nach Chemotherapieende auftritt, wird als protrahiertes Geschehen definiert (sogenannte late emesis).
Im Gegensatz dazu bezeichnet das antizipatorische Erbrechen eine Konditionierung mit Induktion des Brechreflexes nach vorausgegangener Übelkeit und Erbrechen bei früheren Chemotherapiekursen.
19.1 Ursache
Das Brechzentrum des Menschen ist die Area postrema, ein Areal im Hirnstamm mit bestimmten Chemorezeptoren. Die Reizung dieser Chemorezeptoren im Bereich der Medulla oblongata kann durch verschiedene Stimuli ausgelöst werden. Dazu gehören neben Schwindel, psychischem Stress auch gesteigerter intrakranieller Druck oder Bestrahlung. Bei einer Zytostatikatherapie kommt es zur medikamentösen Reizung der Chemorezeptoren im Bereich der Area postrema. Auch Supportiva wie Opioidanalgetika können die Area postrema reizen und zum Erbrechen führen. Darüber hinaus können Zytostatika im Gastrointestinaltrakt Schädigungen induzieren, sodass dort bestimmte Botenstoffe wie Serotonin freigesetzt werden und über entsprechende Rezeptoren (5-Hydroxytryptophan-Rezeptoren) den Brechvorgang aktivieren. Auch dopaminerg wirksame Substanzen können über D-Rezeptoren den Brechreflex auslösen.
Klinisch unterscheidet man Zytostatika mit hoher, mäßiggradiger und niedriger emetogener Potenz (Tabelle unten).
| Wirkstoff | Beginn, h | Dauer, h | Anmerkungen | |
| hohes emetogenes Potenzial | Inzidenz > 90 % | |||
| Cisplatin > 50 mg/m2 | 1–6 | 24–48 | generell ernst | |
| Carmustin > 250 mg/m2 | 2–4 | 4–24 | ||
| Dacarbazin | 1–3 | 1–12 | oft dosislimitierend | |
| Mechlorethamin | 3–6 | 8–24 | ||
| Streptozocin | 1–4 | 12–24 | oft dosislimitierend | |
| Cyclophosphamid > 1,5 g/m2 i. v. | 4–12 | 4–18 | ||
| Cytarabin > 1 g/m2 | 6–12 | 3–5 | ||
| Inzidenz 60–90 % | ||||
| Carmustin < 200 mg/m2 | 2–4 | 4–24 | verzögert, Anorexie | |
| Cyclophosphamid 0,75–1,5 g/m2 i. v. | 4–12 | 4–10 | dosisabhängig | |
| Cytarabin 0,25–1 g/m2 | 6–12 | 3–5 | ||
| Methotrexat > 1 g/m2 | 4–12 | 3–12 | ||
| Dactinomycin | 2–6 | 12–24 | oft dosislimitierend | |
| Doxorubicin < 60 mg/m2 | 4–6 | 1–6 | ||
| Lomustin (CCNU) < 60 mg | 2–6 | 4–6 | häufig schwer | |
| Mitotan | verzögert | persistierend | dosislimitierend | |
| Procarbazin | 24–47 | variabel | dosisabhängig | |
| Nimustin (ACNU) | ||||
| mäßiges emetogenes Potenzial | Inzidenz 30–60 % | |||
| Asparaginase | 1–3 | |||
| Cyclophosphamid < 750 mg/m2 i. v. | 4–12 | 4–18 | ||
| Methotrexat 250–1000 mg/m2 | 4–12 | 2–12 | ||
| Azacitidin | 1–4 | 3–4 | dosisabhängig | |
| Carboplatin | 24 | |||
| Daunorubicin | 2–6 | 24 | schwer | |
| Epirubicin | 1–6 | 1–6 | ||
| Idarubicin | ||||
| Doxorubicin 25–75 mg | 4–6 | 6 | schwer | |
| Fluorouracil > 1g | 3–6 | dosislimitierend | ||
| Hexamethylmelanin | 3–6 | |||
| Mitomycin C | 1–4 | 48–72 | ||
| Irinotecan | ||||
| Topotecan | ||||
| niedriges emetogenes Potenzial | Inzidenz 10–30 % | |||
| Bleomycin | 3–6 | emetische Toleranz | ||
| Cytarabin 20 mg | 6–12 | 3–5 | stärker bei oraler Gabe | |
| Etoposid (VP 16) | 3–8 | |||
| Hydroxyharnstoff | 6–12 | dosisabhängig | ||
| Docetaxel | ||||
| Paclitaxel | 4–12 | |||
| Ifosfamid | 1–2 | ausgedehnt | ||
| Melphalan | 6–12 | |||
| Mercaptopurin | 4–8 | |||
| Methotrexat 50–250 mg/m2 | 4–12 | 3–12 | ||
| Teniposid | 3–8 | |||
| Thiotepa | 6–12 | variabel | ||
| Vinblastin | 4–8 | |||
| Gemcitabin | ||||
| Inzidenz < 10 % | ||||
| Busulfan | ||||
| Chlorambucil | 48–72 | ausgedehnt | ||
| Cyclophosphamid oral | ||||
| Methotrexat < 50 mg/m2 | ||||
| Vinorelbin | ||||
| Thioguanin | 4–8 | |||
| Vincristin | 4–8 | |||
| Fludarabin | ||||
| Cladribin | ||||
19.2 Therapeutische Interventionen
Zur antiemetischen Therapie stehen verschiedene Substanzklassen zur Verfügung; sie ist dem emetogenen Potenzial der Zytostatika anzupassen. Die Tabelle unterhalb gibt einen Überblick über die verschiedenen Klassen der Antiemetika, jeweils mit Inhaltsstoff und Handelsname.
Im klinisch praktischen Gebrauch werden bei hoch und moderat emetogenen Chemotherapien Kombinationen aus 5-HT-3-Antagonisten wie Ondansetron, Tropisetron oder Granisetron in Kombination mit Neurokinin-1 Rezeptorantagonisten wie Aprepitant (Handelsname EMEND® und IVEMEND®) und mit Kortikosteroiden wie Prednison oder Dexamethason eingesetzt. Die Verwendung aller 3 Medikamentenklassen stellt den heutigen Therapiestandard dar. Mit Palonosetron (Handelsname Aloxi®) steht ein 5-HT-3-Antagonist mit einer etwa 36-stündigen Halbwertszeit zur Verfügung. Damit bietet Palonosetron eine antiemetische Wirksamkeit von ca. 4–5 Tagen. Palonosetron ist auch in Kombination mit Netupitant verfügbar (Handelsname Akynzeo). Bei fehlender Wirksamkeit kann diese Initialkombination durch eine andere Antiemetikaklasse ergänzt werden. Bei mäßig- und niedriggradig emetogenen Chemotherapien ist Dexamethason oder ein Benzamid wie Alizaprid oder Metoclopramid ausreichend.
Hoch wirksam bei hoch und moderat emetogener Chemotherapie und ebenfalls als Standardtherapie zu betrachten ist das atypische Neuroleptikum Olanzapin (Handelsname Zyprexa). Dies kann mit 5-HT3 und mit NK-1 Antagonisten kombiniert werden.
| Substanzklasse | Substanzname | Handelsname |
| 5-HT-3-Rezeptorantagonisten (Serotoninantagonisten) | Ondansetron Tropisetron Granisetron Palonosetron | Zofran® Navoban® Kevatril® Aloxi® |
| Neurokinin-1(Nk-1)-Rezeptorantagonisten | Aprepitant Fosaprepitant Rolapitant Netupitant (nur in Kombination mit Palonosetron) | Emend® IVEmend® Varuby® Akynzeo® |
| Benzamide | Metoclopramid Alizaprid | Paspertin®, MCP® Vergentan® |
| Kortikosteroide | Dexamethason | Fortecortin® |
| Antihistaminika | Diphenhydramin | Vomex® |
| Neuroleptika | Olazapin Promethazin Levomepromazin | Zyprexa® Atosil® Neurocil® |
| Benzodiazepine | Diazepam Lorazepam | Valium® Tavor® |
| Cannabispräparate | Dronabinol | Marinol® |
Mit den Neurokinin-1(NK-1)-Rezeptorantagonisten Aprepitant / Fosaprepitant (Handelsname Emend® und iv Emend®) Rolapitant und Netupitant steht eine Medikamentenklasse zur Kombination mit Setronen und Dexamethason bei hoch und mäßig emetogener Chemotherapien zur Verfügung. In der klinischen Praxis wird Aprepitant in Kombination mit einem 5-HT-3-Antagonisten über 3 Tage verabreicht und schützt sowohl vor akuter als auch vor verzögerter Emesis. Fosaprepitant wird einmalig am ersten Therapietag infundiert und schützt 5 Tage vor Übelkeit und Erbrechen. Aufgrund der Einführung dieser Medikamentenklasse ist die Bedeutung der Benzamide wie Metoclopramid deutlich gesunken.
Zur Vermeidung einer antizipatorischen Emesis wird im ersten Therapiezyklus eine maximale antiemetische Prophylaxe verabreicht (auch wenn diese nicht zwingend indiziert ist) und später bei guten Erfahrungen des Patienten deeskaliert, da das antizipatorische Erbrechen ein therapeutisches Problem darstellt. Hier eignet sich eine Ergänzung der klassischen Antiemetika durch psychotrop wirksame Pharmaka (Neuroleptika und Benzodiazepine).
Merke: Die antiemetische Therapie im ersten Behandlungszsklus stellt die Weichen für den gesamten späteren Therapieverlauf. Es gilt das sogenannte Step-Down-Prinzip.
19.3 Pflegerische Maßnahmen
Bevor Ondansetron 1991 als erster Wirkstoff aus der Gruppe der 5-HT3-Rezeptor-Antagonisten zugelassen wurde, waren die meisten Chemotherapien bei Krebserkrankungen unweigerlich mit starker Übelkeit und Erbrechen verbunden. Dies lag an den damals verfügbaren Zytostatika und an den begrenzt zur Verfügung stehenden Antiemetika. Nicht selten führte die dadurch hervorgerufene extreme physische und psychische Belastung der Patienten zu einem Therapieabbruch.
Viele Patienten verbinden auch heute noch spontan eine zytostatische Therapie mit den Symptomen Übelkeit und Erbrechen. Dies bedeutet für die onkologischen Pflegekräfte, schon vor der ersten Zytostatikatherapie ein Risikoprofil des Patienten zu erstellen. Übelkeit und Erbrechen werden von den Patienten individuell erlebt und die Symptomatik ist multifaktoriell. Schon im Vorfeld einer Krebsbehandlung müssen die Ängste und Sorgen hinsichtlich der Therapie erkannt und berücksichtigt werden.
Die pflegerische Anamnese muss sich an den potenziellen Problemen im Hinblick auf Nausea und Emesis orientieren. Individuelle Faktoren wie schlechte Vorerfahrungen, anhaltende Übelkeit in der Schwangerschaft, Reiseübelkeit oder ein „nervöser Magen“ sollten als individuelle Faktoren erfasst werden und gegebenenfalls die Therapie angepasst werden. Auch die Belastbarkeit des Patienten sollte eruiert werden.
Die pflegerische Patientenberatung ist hier besonders gefordert. Onkologisch Pflegende müssen genaue Kenntnisse über die Behandlungsstrategie und das zu erwartende Nebenwirkungsspektrum haben. Diese Informationen müssen verständlich und den Informationsbedürfnissen des Patienten entsprechend vermittelt werden. Eine angstreduzierende Maßnahme ist das pflegerische Beratungs- und Informationsgespräch, in dem der Patient auch seine Sorgen und Nöte einbringen sollte, um dann die für ihn effektiven medikamentösen antiemetischen Therapien zu erläutern.
19.4 Patienteninformation und Beratung
Patienten müssen über die zu erwartende Form der chemotherapieinduzierten Nausea und Emesis (CINE) Problematik und die dazugehörige medikamentöse Antiemese informiert werden. Es kann hilfreich sein, dem Betroffenen und den Angehörigen Informationsmaterial darüber mit nach Hause zu geben. Gerade die verzögerte Nausea und Emesis läuft Gefahr, nicht ausreichend und adäquat behandelt zu werden. Die meisten Patienten erleben diese Form des Erbrechens bzw. der Übelkeit in der ambulanten Phase und somit in der häuslichen Umgebung. Die betroffenen Patienten benötigen eine zur Verfügung stehende Bedarfsmedikation und eine entsprechende Anleitung zur Einnahme der Antiemetika. Eine 24-Stunden-Erreichbarkeit des Behandlungsteams sollte gegeben sein. Angehörige sollten nach Möglichkeit unterstützend in die Beratung einbezogen werden.
„Übelkeit und Erbrechen sind nicht identisch. Beide Symptome treten nicht unbedingt gemeinsam und gleichzeitig auf. Übelkeit und Erbrechen werden von Patient zu Patient unterschiedlich gewichtet. Für viele Patienten ist Übelkeit schwieriger zu ertragen als das eigentliche Erbrechen.“[4] Aus diesem Grund sollte darauf geachtet werden, beide Nebenwirkungen getrennt voneinander zu befragen. Nur so ist eine professionelle Erfassung der Nebenwirkung sinnvoll.
Obwohl Nausea und Emesis individuell erfahren und erlebt werden, gibt es Faktoren, die sich lindernd oder verstärkend auswirken.
Patienteninformation: Was der Patient tun kann / lindernde Maßnahmen [5]
- für Ruhe und Entspannung sorgen
- Entspannungsübungen und Atemtechniken üben, langsam ein- und ausatmen, wenn Übelkeit verspürt wird
- leichte Kost essen und die Mahlzeiten auf mehrere kleine Portionen über den Tag verteilt zu sich nehmen
- trockene Kost probieren (Zwieback, Toast, Knäckebrot …)
- nur das essen, worauf man Lust hat; keine Lieblingsspeisen, weil diese sonst mit Übelkeit und Erbrechen in Verbindung gebracht werden
- übrig gebliebenes Essen nicht im Raum stehen lassen
- wenn man keinen Appetit hat, versuchen, flüssige Nahrung zu sich zu nehmen, damit man bei Kräften bleibt
- auf gesunde und ausgewogene Ernährung achten
- nach den Mahlzeiten ausruhen
- Bonbons mit nachhaltigem Geschmack lutschen
- auf ausreichend Flüssigkeit achten, z. B. gefrorene Fruchtstückchen lutschen oder Pfefferminztee oder Melissentee versuchen
- langsam bewegen, spazieren gehen an der frischen Luft
- die Wohn- und Schlafräume gut lüften, um starke Gerüche zu vermeiden, gegebenenfalls Raumspray verwenden; eventuell vorsichtige Versuche mit naturreinen ätherischen Ölen; Cave: kann wiederum Übelkeit verursachen
Patienteninformation: Was der Patient meiden sollte / verstärkende Faktoren [5]
- Stress
- Rauchen
- Alkohol trinken
- starker Gewichtsverlust
- immer dasselbe essen (Gefahr, dass Lieblingsspeisen nicht mehr vertragen werden)
- essen und trinken, wenn man gerade Übelkeit verspürt oder erbrochen hat; 4–6 Stunden warten, bevor man nach heftigem Erbrechen wieder feste Nahrung zu sich nimmt
- geruchsintensive Speisen und Getränke nach der Chemo zubereiten
- stark gewürzte, stark gesüßte oder zu heiße Speisen oder Getränke zu sich nehmen
- mit vollem Magen Sport treiben
- zu wenig trinken (führt zusätzlich zum Erbrechen zu Komplikationen wie Blutdruckabfall, Kreislaufschwäche, Austrocknung u. a.)
- süßliche, stark duftende Parfüme und Körperpflegemittel verwenden
19.5 Assessment / Erfassen und Beurteilen
Da Nausea und Emesis individuell erfahren werden, ist eine Beurteilung ohne das Einbeziehen der betroffenen Patienten nicht möglich. Das subjektive Empfinden kann von den Patienten mit entsprechenden Hilfsmitteln beschrieben und beurteilt werden.
Auch in diesem Bereich sind Skalen (VAS = visuelle Analogskala, NRS = nummerische Analogskala) nützlich und hilfreich. Eine weitere Möglichkeit zur Erfassung von Übelkeit und Erbrechen bietet die NCI-CTCAE-Einteilung (folgende Tabelle).
| Grad | Übelkeit | Erbrechen |
| 1 | Appetitverlust ohne Änderung der Essgewohnheiten. | Frequenz 1–2 pro 24 h (5 min voneinander getrennt) |
| 2 | Orale Aufnahme verringert ohne wesentlichen Gewichtsverlust, Dehydratation oder Mangelernährung. | Frequenz 3–5 pro 24 h (5 min voneinander getrennt) |
| 3 | Unzureichende orale kalorische oder flüssige Aufnahme; Sondenernährung; Totale Parenterale Ernährung (TPE) oder Krankenhauseinweisung angezeigt | Frequenz >= 6 pro 24 h (5 min voneinander getrennt); Ernährungssonde, TPE oder Krankenhauseinweisung angezeigt (24 h) |
| 4 | – | Lebensbedrohliche Konsequenzen; dringliche Intervention angezeigt |
| 5 | – | Tod |
| Definition: Eine Störung, gekennzeichnet durch ein mulmiges Gefühl und / oder den Drang zu erbrechen. | Definition: Eine Störung, gekennzeichnet durch den reflexiven Akt des Auswerfens des Mageninhaltes durch den Mund. |
19.6 Pflegerische unterstützende Maßnahmen/Interventionen
Onkologisch Pflegende sollten während der zytostatischen Behandlung auf ein spontan einsetzendes Erbrechen vorbereitet sein.
Hilfreich ist:
- Schale und Tücher in nicht sichtbare Reichweite stellen
- Erbrochenes schnell entsorgen
- bequeme Lagerung ermöglichen
- Räume lüften
- Stirn, Gesicht und Hals kalt abwaschen
- Mundspülungen nach Bedarf anbieten
- Mundhygiene nach dem Erbrechen ermöglichen
Im Vorfeld können Pflegende mit geringem Aufwand gute Bedingungen für die Behandlung schaffen. Eine beruhigende und entspannte Atmosphäre gibt dem Patienten Sicherheit. Ablenkende Maßnahmen, wie Lesen, Fernsehen, Besuchsmöglichkeiten, Gespräche, werden von den meisten Patienten als hilfreich und unterstützend angesehen. Angenehme Gerüche können durch Aromatherapie und Duftöle erzielt werden. Konkrete Ansprechpartner im Rahmen der Bereichspflege ermöglichen eine Vertraulichkeit und geben dem Patienten weitere Sicherheit. Auch für Pflegende ist eine kontinuierliche und intensive Betreuung von Patienten von enormem Vorteil. Veränderungen und Probleme können eher und gezielter erkannt und beurteilt werden. Somit ist ein frühes Intervenieren möglich.
Hilfreich ist das sorgfältige Führen eines Patiententagebuches. Dies gibt den Pflegenden die Möglichkeit, über den gesamten Zeitraum der Behandlung den Verlauf der Nausea und Emesis nachzuvollziehen und zu beurteilen.
Die kontinuierliche Dokumentation von Übelkeit und Erbrechen ist eine Voraussetzung für die Beurteilung und die entsprechende Behandlung. Hier kommt der Pflege eine tragende Rolle zu. Nur durch eine kontinuierliche Evaluation können die medikamentöse Therapie und die pflegerischen Maßnahmen gezielt beurteilt und angepasst werden.
Die ganzheitliche Behandlung von Patienten mit einer durch Chemotherapie induzierten Nausea und Emesis beinhaltet alle therapeutischen Maßnahmen, durch die der Patient entlastet werden kann. Dazu zählen:
- eine leitliniengestützte medikamentöse Therapie
- eine individuell auf den Patienten ausgerichtete Pflegeplanung
- bei Bedarf eine psychoonkologische Unterstützung (antizipatorisches Erbrechen)
- Angebote aus den Bereichen der Kunst- und Musiktherapie, falls vorhanden und möglich
- Entspannungsverfahren
- Akupunktur oder Akupressur
- Yoga usw.
Die beschriebenen Maßnahmen müssen individuell und gemeinsam mit dem Patienten abgestimmt werden. Dies wird in der Regel zu einer Linderung der belastenden Symptomatik führen. Letztendlich bedeutet dies für die Betroffenen eine Stärkung der Selbstkontrolle und eine Verbesserung der Lebensqualität.
Literatur
- Lipp 1994
- Hesketh et al 1997
- Pühler H et al 1995
- Hlawatsch C & Oechsle K (2017) Übelkeit und Erbrechen. In Margulies A, Kroner Th, Gaisser A, Bachmann-Mettler I (Hrsg.) Onkologische Krankenpflege, Springer, S. 371–387
- Schmoll HJ, Jordan K (2006) Patientenbroschüre „Übelkeit und Erbrechen als Folge der Chemotherapie – Was Patienten heute wissen sollten“, MSD
- Bäumer R, Maiwald A (2008) Thiemes Onkologische Pflege, Thieme, S. 161–170
20 Spezielle Nebenwirkungen bei immunonkologischen Therapien
Allgemeines: Immunonkologische Therapien mit Checkpoint-Inhibitoren gelten als gut verträgliche Therapien, jedoch können die Nebenwirkungen prinzipiell jedes Organ bzw. Organsystem betreffen.
20.1 irAEs – immune related Adverse Events, nicht hämatologisch
Im Gegensatz zur zytostatischen Chemotherapie liegt jedoch nicht eine Toxizität gegenüber schnell proliferierenden Zellen zu Grunde, sondern die Induktion einer „Immunreaktion“, die sich „fehlerhafterweise“ gegen normale, gesunde Körperzellen richtet (Verlust der Selbsttoleranz). Hier wurde schnell der Begriff irAE = immune related Adverse Events geprägt, der international ein feststehender Begriff ist.
Bereits aus diesem Mechanismus leitet sich ab, dass die grundlegende Therapie einer immunogenen Toxizität eine immunsuppressive Therapie ist, in aller Regel eine Steroidtherapie.
Als die vier häufigsten Toxizitäten gelten die Hauttoxizität, Durchfall, Hepatotoxizität und endokrinologische Nebenwirkungen. Seltene, aber gefürchtete Nebenwirkungen sind die Pneumonitis und die Myokarditis. Dabei ist die Monotherapie mit einem PD-1- / PD-L1-Inhibitor besser verträglich als die Therapie mit einem CTLA-4-Inhibitor bzw als die Kombination aus PD-1 / PD-L1 und CTLA-4 Antikörper. Im Gegensatz zu anderen Antikörpertherapien sind Infusionsreaktion sehr selten und treten nicht so häufig auf wie bei chimären Antikörpern, so dass eine routinemässige Prämedikation mit einem Steroid nicht erforderlich ist.
20.1.1 Hauttoxizität immunonkologischer Therapien
Bei etwa 5–10 % der Patienten kommt es zu kutanen Nebenwirkungen wie Erythemen und ekzemartigen Veränderungen, die zum Teil von einem ausgeprägten Juckreiz begleitet werden. Auch ein Pruritus sine materiae ist möglich. Ausgelöst wird der Juckreiz durch intradermale Aktivierung von T-Zellen (vergleichbar dem Juckreiz einer frühen HIV-Erkrankung). In der Regel kann die Diagnose „blickoptisch“ gestellt werden, wenn bekannt ist, dass der Patient eine Behandlung mit einem Immuncheckpoint-Inhibitor erhält. Bei ausgeprägten Verläufen, die ausgedehnte Teile des Integumentes betreffen, empfiehlt sich jedoch eine fachdermatologische Untersuchung. Eine Therapie mit topischen Steroiden ist meistens ausreichend und auch effektiv gegen den Juckreiz, selten sind systemische Steroide erforderlich.
20.1.2 Intestinale Toxizität immunonkologischer Therapien
Durch eine Immunreaktion gegen das Darmepithel (Mechanismus wie bei einer Colitis ulcerosa) kommt es zu Durchfällen, bei etwa 15–20 % zu leichtgradigen, bei 1–3 % zu höhergradigen Durchfällen. Die Gradeinteilung der Durchfälle erfolgt dabei wie bei Durchfällen durch Chemotherapie oder Tyrosinkinase-Inhibitoren nach den CTC (Common-Toxicity-Criteria) Kriterien des National Cancer Institutes (NCI). Von klinisch praktischer Relevanz sind dabei insbesondere Grad III Diarrhoen, da diese in kurzer Zeit zu massiven Flüssigkeitsverlusten und Elektrolytstörungen führen können und in aller Regel eine Hospitalisation des Patienten bedingen. Komplizierend bei höhergradiger Diarrhö kann es zu einem prärenalen Nierenversagen kommen. Bei einer Grad III Diarrhö ist die Therapie mit dem Immuncheckpoint-Inhibitor zu unterbrechen. Die Umfelddiagnostik sollte immer eine Stuhluntersuchung auf allgemeine Erreger wie Salmonellen, Shigellen, Yersinien, Camphylobacter und Clostridien enthalten. Im Gegensatz zur chemotherapieassoziierten Diarrhö ist eine Behandlung mit Loperamid nicht Mittel der Wahl und wirkt nur bei leichtgradigen Grad I Durchfällen. Die Basistherapie neben ausreichender Rehydratation ist eine systemische Steroidtherapie, die bereits bei Verdacht eingeleitet werden sollte und die den Grundsätzen der Behandlung einer Colitis ulcerosa ähnelt (Beginn mit einmal täglicher Gabe, dann Dosissteigerung, dann intravenöse Gabe, dann Steroidgabe morgens und abends mit Aufhebung der Kortisol-Tagesrhythmik). Bei ausbleibendem Erfolg sollte eine koloskopische Biopsie erfolgen. Nach den Biopsieergebnissen erfolgt dann eine Therapie mit Infliximab oder einem Interleukin-6 Antikörper.
20.1.3 Hepatotoxizität immunonkologischer Therapien
Unter einer Therapie mit Immuncheckpoint-Inhibitoren kann es zu einer „fehlerhaften Reaktion“ von T-Zellen gegen normale Hepatozyten kommen. Dies ist vom Mechanismus einer Autoimmunhepatitis vergleichbar. Häufig ist dabei die Erhöhung der Leberwerte ein Zufallsbefund in einer routinemässigen Kontrolle und wird vom Patienten zunächst nicht bemerkt. Die ersten Symptome sind unspezifisch wie Müdigkeit, Abgeschlagenheit, Druckgefühl im Oberbauch und Inappetenz. Wegweisend ist jedoch der Ikterus, der zunächst an den Skleren sichtbar wird und erst bei Bilirubinkonzentrationen > 3 mg/dl die gesamte Haut betrifft. Durch vermehrte Freisetzung von Gallensäuren kommt es zum Pruritus. Die Diagnosesicherung erfolgt laborchemisch, sonographisch sieht man meist eine etwas vergrößerte ödematös veränderte Leber. Therapeutisch ist die Checkpoint-Inhibitor-assoziierte Hepatitis sensibel gegenüber niedrigen Steroiddosen (wie eine Autoimmunhepatitis). Hinweis: eine Intervention mit Infliximab wird bei einer Autoimmunhepatitis wegen der Infliximab eigenen Hepatotoxizität kritisch gesehen.
20.1.4 Endokrinologische Toxizitäten
Die häufigste endokrinologische Nebenwirkung ist eine Schilddrüsenfunktionsstörung, wobei sowohl eine Hyper- als auch eine Hypothyreose auftreten kann. Dabei ist die Hypothyreose mit einer Häufigkeit von 8–10 % die häufigste endokrine Nebenwirkung. Klinisch manifestiert sich die Hypothyreose mit Müdigkeit, Abgeschlagenheit (Fatigue-Syndrom), Obstipation, Kältegefühl und Bradykardie. Die Haut fühlt sich teigig an. Bei Maximalvariante kommt es zum sogenannten Myxödemgesicht. Im Gegensatz dazu kommt es bei einer Hyperthyreose zu Durchfall, Hitzeintoleranz (Frage an den Patienten, ob er sich lieber in warmen oder kalten Räumen aufhält!), Gewichtabnahme, Unruhe und Tachykardie. Bei klinischem Verdacht erfolgt die Diagnose laborchemisch durch die Bestimmung von TSH, T3 und T4. Bei asymptomatischen Patienten ist ein routinemässiges Monitoring dieser Parameter mindestens alle drei Monate empfohlen, in den amerikanischen NCCN-Guidelines sogar alle sechs Wochen. Bei einer Hypothyreose erfolgt die Therapie durch orale Substitution von Levothyroxin (T4), eine Steroidbehandlung ist hier primär nicht indiziert. Die Therapie der Hyperthyreose erfolgt mittels Thyreostatika wie Carbimazol, bei schweren Verläufen kann eine Steroidbehandlung erforderlich werden. Eine thyreotoxische Krise erfordert sogar die Therapie auf einer Überwachungsstation.
Seltener sind Störungen der Nebennierenfunktion im Sinne einer immunogenen Adrenalitis (Entzündung der Nebennieren) und Störungen der Hypophysenfunktion im Sinne einer Hypophysitis (seltenste endokrine Toxizität).
Die Adrenalitis führt zur Unterfunktion der Nebennieren, vom Mechanismus einem Morbus Addison vergleichbar. Klinisch kommt es zur Adynamie, Hypotonie und Hyperpigmentierungen an den Handinnenflächen und den Schleimhäuten. Die Diagnose wird über die Bestimmung von ACTH und Kortisolspiegel im Tagesverlauf gestellt. Da bei einer Nebenniereninsuffizienz häufig Elektrolytstörungen auftreten, ist eine Bestimmung und ein Monitoring der Elektrolyte erforderlich. Therapeutisch ist eine Substitution von Hydrokortison erforderlich. Bei schwerem Verlauf (vergleichbar einer Addisonkrise) kann die Behandlung auf einer Überwachungsstation erforderlich sein.
Eine Hypophysitis kann zum Ausfall aller Hormonachsen führen und so die Symptome einer Hypothyreose, einer Nebenniereninsuffizienz und einer gonadotropen Insuffizienz auslösen. Dabei fällt die gonadotrope Achse als erstes aus. Da bei der Hypophysitis die Hypophyse anschwillt und größer wird, kommt es jedoch primär zu Kopfschmerzen und Sehstörungen! Diagnostisch kann die hydropische Hypophyse eindrucksvoll in einer MRT-Untersuchung dargestellt werden. Laborchemisch sind neben den o.g. endokrinen Parametern zusätzlich LH und FSH zu bestimmen. Therapeutisch ist die hormonelle Substitution aller in Mitleidenschaft gezogenen Achsen erforderlich, Steroide eignen sich gut zum Abschwellen der ödematös veränderten Hypophyse.
20.1.5 Pneumonitis
Eine höhergradige Pneumonitis tritt mit einer Wahrscheinlichkeit von 1–4 % auf. Meist tritt eine Pneumonitis erst im späteren Verlauf einer immunonkologischen Therapie auf. Wesentliches Symptom ist eine zunehmende Atemnot im Verbund mit einem unproduktiven Reizhusten. Die Diagnose erfolgt über eine hochauflösende thorakale Computertomographie (HR-CT). Es finden sich unregelmässige und fleckförmige sowie zum Teil milchglasartige Infiltrate. Eine Bronchoskopie mit bronchoalveolärer Lavage und transbronchialer Lungenbiopsie kann die Diagnose histologisch beweisen, ist jedoch nicht bei allen Patienten möglich (Gefahr der längerfristigen Beatmung bei COPD-Patienten). Die Steroidtherapie sollte schnellstmöglichst erfolgen. Bei schwerwiegendem Verlauf oder unzureichendem Ansprechen auf die Prednisontherapie kommen Salvagebehandlungen wie Infliximab, Interleukin-6 Antikörper oder auch Cyclophosphamid zum Einsatz.
20.1.6 Myokarditis und kardiale Ereignisse
Mit einer Häufigkeit von ca. 1 % ist die Myokarditis eine sehr seltene Komplikation einer Therapie mit Immuncheckpoint-Inhibitoren. Prognostisch ist die Myokarditis jedoch sehr ungünstig und führt bei 50 % der betroffenen Patienten zum Tode! Die Immunreaktion kann dabei zu irreversiblen Nekrosen der Myokardzellen führen. Symptomatisch führend sind dabei thorakale retrosternale Schmerzen und die Symptome einer akuten Herzinsuffizienz wie Luftnot und Ödeme. Die Diagnosesicherung erfolgt mittels EKG und laborchemischer Bestimmung der CK und CK-MB sowie Troponin. Die Echokardiographie zeigt meist eine verminderte Ejektionsfraktion und einen Perikarderguß. Eine Koronarangiographie ergibt meist keine weiterführenden Befunde. Die Infiltration von Lymphozyten im Myokard kann durch eine Myokardbiopsie gesichert werden (wird jedoch selten durchgeführt). Die Therapie erfolgt in der Initialphase auf einer Überwachungsstation (Rhythmusmonitoring erforderlich). Eine hochdosierte Steroidtherapie ist erforderlich, intensivierte immunsuppressive Therapien sollten frühzeitig zum Einsatz kommen. Aufgrund der schlechten Prognose wird ein regelmäßiges Troponin und CK-MB Monitoring diskutiert. Werden alle kardialen Ereignisse zusammengefasst (Myokarditis, Perikarditis, Arrhythmien, Herzinsuffizienz und plötzlicher Herzstillstand) liegt die Rate an myokardialen Komplikationen gemäss einer aktuellen dänischen Registerstudie deutlich höher bei 7–10 %.
20.1.7 Immunogene Pankreatitis
Eine Pankreatitis unter Behandlung mit einem Immuncheckpoint-Inhibitor tritt ebenfalls mit einer Häufigkeit von etwa 1 % auf. Bei unklaren abdominellen Beschwerden wie Übelkeit, Erbrechen (Checkpoint-Inhibitoren sind keine emetogenen Therapien!) im Verbund mit diffusen, teilweise gürtelförmigen Bauchschmerzen sollte an eine Pankreatitis gedacht werden. Komplizierend können Fieber, Hypotonien und Blutzuckererhöhungen auftreten. Laborchemisch wird die Diagnose über eine Erhöhung der Lipase gestellt. Auch ein Blutbild, CRP, Leberwerte und Glucose sollten bestimmt werden. Die Behandlung richtet sich nach den Grundsätzen der Pankreatitistherapie mit initialer Nahrungskarenz und stufenweisem Kostaufbau, großzügiger Volumengabe (oft zentral-venöser Katheter erforderlich) und analgetischer Therapie. Darüber hinaus soll eine zügige Steroidtherapie eingeleitet werden.
20.1.8 Nephritis und Niereninsuffizienz
Kreatininerhöhungen finden sich bei 3 % unter Therapie mit einem Immuncheckpoint-Inhibitor, darüber hinaus gibt es wenig Daten über immunogene Nephritiden. Meist fällt die Kreatininerhöhung im Rahmen einer Routinelaborkontrolle auf. Symptome können farbliche Veränderungen des Urins sein (Hämaturie), auch kann der Urin schäumen (Proteinurie). Auch Flankenschmerzen sind beschrieben. Diagnostisch weist die Urin-Stix Untersuchung sowohl Erythrozyten als auch Eiweiß nach. Ein typischer Befund in der Nierenbiopsie ist aktuell nicht bekannt. Therapeutisch ist die Zufuhr von Flüssigkeit erforderlich (Nierenspülung) sowie eine Steroidtherapie. Die prognostische Signifikanz der Kreatininerhöhung ist aktuell unklar.
20.1.9 Neurologische Toxizitäten
Immunonkologische Therapien können sowohl „zentrale“ als auch „periphere“ neurologische Krankheitsbilder auslösen.
Sehr selten sind zentrale immunogene Encephalitiden und Meningitiden (< 1 %). Symptome sind Wesensveränderungen, Bewusstseinsstörungen, Kopfschmerzen, Nackensteifigkeit, Photophobie oder Krampfanfälle. Auch Guillian-Barré-ähnliche Krankheitsbilder können auftreten. Hier ist eine zügige neurologische Diagnostik mit MRT und Lumbalpunktion erforderlich, umfelddiagnostisch sollte nach Herpes- und Zytomegalieencephalitiden gesucht werden. Therapeutisch ist neben einer Prednisontherapie auch oft eine antiödematöse Therapie erforderlich.
Leichtgradige periphere Polineuropathien treten bei 4 % der behandelten Patienten auf. Auch hier ist die neurologische Differenzierung gegenüber anderen Polineuropathien erforderlich (z. B. diabetische PNP, chemotherapieinduzierte PNP etc.). Die erfolgt mittels Elektroneurographie (ENG). Therapeutisch ist bei gesicherter oder wahrscheinlicher Diagnose ein Steroidversuch gerechtfertigt.
20.1.10 Myositis
Eine immunogene Myositis bzw. eine echte Rhabdomyolyse (definiert als CK > 1000 mg/dl) ist ebenfalls eine sehr seltene Nebenwirkung (< 1 %). Im Gegensatz dazu treten leichtgradige Myalgien bei bis zu 7 % der Pateinten auf. Symptomatisch besteht eine muskuläre Schwäche neben den Muskelschmerzen, was die Abgrenzung gegenüber neurologischen Krankheitsbildern erschwert. Laborchemisch sind meist die Gesamt-CK und das Myoglobin erhöht (die CK-MB ist aber normal, Abgrenzung zur myokardialen CK). Ob eine Muskelbiopsie beweisende Befunde liefern kann, ist aktuell noch unklar. Bei einer Rhabdomyolyse ist eine intensive Hydratation erforderlich, da die erhöhte CK zu Nierenversagen führen kann. Kurzfristig eingesetzte Steroide können zur symptomatischen Besserung führen.
20.2 Hämatologische irAEs (hem-irAEs)
Wie bei der Autoimmunmyokarditis war man lange Zeit der Überzeugung, dass es unter ICIs keine hämatologische Toxizität gibt. Vor dieser wurde erstmalig im Januar 2017 im Bulletin zur Arzneimittelsicherheit des PEI und BfArM gewarnt. Mittlerweile finden sich in den Fachinformationen der spezifischen Substanzen folgende hem-irAE (siehe folgende Tabelle):
| INN | Ziel | Erkrankungen des Blutes und des Lymphsystems |
| Atezolizumab | PD-L1 | Häufig Thrombozytopenie |
| Avelumab | PD-L1 | Sehr häufig Anämie Häufig Lymphopenie Gelegentlich Thrombozytopenie, Eosinophilie |
| Cemiplimab | PD-1 | Lymphopenie Hämolytische Anämie Aplastische Anämie Hämophagozytische Lymphohistiozytose Immunthrombozytopenische Purpura, |
| Durvalumab | PD-L1 | Selten Immunthrombozytopenie |
| Ipilimumab | CTLA4 | Häufig Anämie, Lymphopenie Gelegentlich Hämolytische Anämie, Thrombozytopenie, Eosinophilie, Neutropenie Nicht bekannt Hämophagozytische Histiozytose |
| Nivolumab | PD-1 | Sehr häufig Neutropenie Selten Eosinophilie |
| Pembrolizumab | PD-1 | Sehr häufig Anämie Häufig Thrombozytopenie, Lymphopenie Gelegentlich Neutropenie, Leukopenie, Eosinophilie Eosinophilie Selten Immunthrombozytopenische Purpura, hämolytische Anämie, isolierte aplastische Anämie, hämophagozytische Lyphohistiozytose |
| Stand 02/2021; jeweils ohne CTX gemäß der zu dem Zeitpunkt gültigen FI/FPI | ||
In der internationalen Literatur sind weitere sehr seltene hem-irAEs beschrieben wie Hämophilie A, akute Thrombosen, groß-granuläre Lymphozytose (large granular Lymphocytes), hämophagozytische Lymphohistiozytose, Makrophagen-Aktivatierungssyndrom und Eosinophilie.
Literaturberichte hämatologischer Zytopenien, die eine oder mehrere Zelllinien betroffen haben, beschreiben sehr selten ir-Neutropenie, autoimmunhämolytische Anämie, ir-Thrombozytopenie (ir-TCP) und Panzytopenien.
20.3 Fortführung der Immuntherapie nach toxizitätsbedingter Unterbrechung
Im klinischen Alltag stellt sich häufig die Frage nach der Fortführung einer bis dahin wirksamen immunonkologischen Therapie nach nebenwirkungsbedingter Therapieunterbrechung. In der Regel führen leichtgradige Toxizitäten (Grad I und II nach den NCI-CTC-Kriterien) nicht zu einer Unterbrechung der Therapie mit einem Immuncheckpoint-Inhibitor. Erst bei Grad-III- und -IV-Toxizitäten wird die Therapie unterbrochen. Bei einer vital bedrohlichen Komplikation wie einer beatmungspflichtigen Pneumonitis oder einer schweren Myokarditis sollte die immunonkologische Therapie definitiv abgesetzt und nicht wieder aufgenommen werden. Bei allen anderen Komplikationen ist es prinzipiell lege artis, die Therapie fortzuführen. Dabei gilt als Faustregel, dass nach Reexposition eine 50 %-Wahrscheinlichkeit für das Auftreten irgendeiner erneuten immunogenen Toxizität besteht. Bei den 50 % der Patienten, die nach Fortführung eine erneute immunogene Nebenwirkung erleiden, ist dann die Wahrscheinlichkeit, dass die gleiche Nebenwirkung erneut auftritt, wieder 50 %, d. h. in der Hälfte der Fälle tritt eine andere immunvermittelte Nebenwirkung auf. Damit liegt bei Reexposition die Wahrscheinlichkeit für ein erneutes Auftreten der gleichen Toxizität, die zur Unterbrechung der Therapie geführt hat, bei insgesamt 25 %.
20.4 Einfluss einer Steroidtherapie auf die onkologische Prognose
Des Weiteren stellt sich klinisch oft die Frage nach einer Verschlechterung der onkologischen Krankheitsprognose, da Steroide zur Behandlung von Nebenwirkungen, den Wirkmechanismus der Immuncheckpoint-Inhibitoren „antagonisieren“ können. Diese Frage ist aktuell schwer und wahrscheinlich nicht abschließend zu beantworten. Als gesichert gilt, dass Patienten, die mit einer Prednisondauertherapie die Behandlung mit einem Immuncheckpoint-Inhibitor beginnen, eine eingeschränkte Wirksamkeit und damit eine schlechtere Prognose der onkologischen Grunderkrankung aufweisen. Dies gilt insbesondere für COPD-Patienten, die dauerhaft steroidpflichtig (Tagesdosen um 10 mg täglich) sind. Für Patienten, die die immunonkologische Therapie ohne Steroid beginnen und nur zur Behandlung von Nebenwirkungen im Verlauf passager ein Steroid erhalten, scheint dies jedoch nicht zu gelten. Hier ist die onkologische Prognose vergleichbar mit der Prognose der Patienten, die nie ein Steroid erhalten haben. Bei Kombinationstherapien von ICI mit konventioneller, emetogener Chemotherapie blieb die Steroidgabe im Rahmen der antiemetischen Prophlaxe in den initialen Studien erhalten, neuere Studien u. a. mit nanoliposomalen Paclitaxel haben jedoch auf die Steroidgabe verzichtet.
20.5 Glukokortikoide im Rahmen der Antiemes bei Kombinationstherapien von ICI mit konventioneller CTX
Bei einer Kombinationstherapie von ICI mit konventioneller, emetogener CTX bleibt die Steroidgabe im Rahmen der emetischen Prophlaxe zwingend erhalten (siehe Teil Grundlagen Abschnitt Immunagonistische Antikörper):
Literatur
Amiri-Kordestani L et al., Data by US Food & Drug Administration, ASCO 2019
Barth J, Krankenhauspharmazie 2016, 37: 333–44
Bonaca MP, Circulation 2019, 140(2): 80–91
D’Souza M, Eur Heart Journal 2020, 00, 1–11
Ferris R et al., New Engl J Med 2016, 375 (19): 1856–67
Gautschi O et al., Swiss Medical Forum 2016, 16: 836–41
Hodi FS et al., 2010 N Engl. J Med 2010; 363(8): 711–23
Johnson DB et al., N Engl J Med 2016, 375 (18): 1749–55
Larkin E et al., European Cancer Conference 2015, #3305
Mahmood SS et al., J Am Coll Cardiol 2018, 71 (16): 1755–64
Maker AV et al., Ann Surg Oncol 2005 (12): 1005–16
Martins F et al., Lancet Oncol 2019, 18: 30828–3
Motzer RJ et al., N Engl J Med 2018, 378; 14; 1277–1290
Schachter J et al., ASCO 2016, Abstract # 9504
Slangen RM et al., World J Gastrointest Pharmacol Ther. 2013, 4(3): 80–2
Spallarosa P et al., J Clin Oncol 2019, 37(25): 2201–2205
Topalian SL et al., N Engl J Med 2012, 366: 2443–54
Topalian SL et al., J Clin Oncol 2014, 32: 1020–30
Weber JS, Kahler KC, Hauschild A. et al. J Clin Oncol. 2012; 30: 2691–2697
Weber JS et al., J Clin Oncol. 2013, 31: 4311–8
Weber JS, et al. J Clin Oncol. 2015, 33: 2092–9
Wolchok JD et al., N Engl J Med 2013, 369: 122–33
Wolchok JD et al., ASCO 2015, Abstract # LBA1
21 Dokumentationsbogen
Die World Health Organisation (WHO) veröffentlichte 1979 ihr WHO Handbook for Reporting Results of Cancer Treatment. Die Krebsbehandlungen und ihre toxischen Wirkungen werden seither in Studien international standardisiert nach Schweregraden erfasst und dokumentiert. Parallel zu den Fortschritten in der Krebsbehandlung werden Assessmentinstrumente von der WHO, nationalen und internationalen Fachgesellschaftlichen oder staatlichen Behörden weiter- und neuentwickelt und mit Tools zur Lebensqualitätsmessung ergänzt.
Neben hoher psychometrischer Güte sollten weitere Eigenschaften erfüllt sein, z. B.:
- in Forschung (Studien) und Krankenversorgung einsetzbar
- interprofessionell nutzbar (Medizin und Pflege)
- Versionen zur Fremd- und Selbsteinschätzung vorliegend
21.1 Common Terminology Criteria for Adverse Events (NCI-CTCAE) Version 5.0
Die NCI-CTCAE des National Cancer Institute (NCI) in den USA ist eine beschreibende Terminologie unerwünschter Ereignisse, deren Stärke von Grad 1 bis Grad 5 beschrieben werden (gering, mäßig, schwer, lebensbedrohlich, Tod). Zur Beurteilung der Schweregrade fließen auch Einschränkungen bei den Aktivitäten des täglichen Lebens (ATL) ein. Instrumentelle ATL: Telefonieren, Einkaufen, Kochen, Haushalt, Wäsche, Verkehrsmittel, Medikamentenmanagement, Geldgeschäfte. Selbstversorgende ATL: Baden, An- und Ausziehen, selbständig essen, Toilettenbenutzung, Einnahme von Medikamenten und fehlende Bettlägerigkeit.
https://ctep.cancer.gov/protocoldevelopment/electronic_applications/docs/CTCAE_v5_Quick_Reference_5x7.pdf (aufgerufen am 17.04.2024)
21.2 Allgemeine Terminologie und Merkmale unerwünschter Ereignisse
Eine deutsche Übersetzung der NCI-CTCAE auf der Basis der Version 4.03 (2017) stellt das Deutsche Krebsforschungszentrum Heidelberg (DKFZ) zu Verfügung:
Die Definitionen der unerwünschten Ereignisse und die Schweregrade entsprechen denen der Version 5.0.
Je nach Toxizitätsprofil einer Therapie könnte eine Auswahl typischer Nebenwirkungen in einem Symptomtagebuch zusammengestellt werden.
21.3 Patient-Reported Outcomes version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE™)
PRO-CTCAE™ wurde 2011 vom NCI ergänzend zur NCI-CTCAE entwickelt, um symptomatische Toxizitäten auch durch Selbsteinschätzung (Patient Reported Outcomes) bei Erwachsenen, Jugendlichen und Kindern zu bewerten. Die Perspektive der Patienten soll bei der Erfassung unerwünschter Ereignisse erfasst und dokumentiert werden.
Seit 2016 liegt für Patienten ab 18 Jahre eine validierte deutsche Übersetzung vor. Die deutsch- und anderssprachigen Versionen werden vom NCI zum Download bereitgestellt: https://healthcaredelivery.cancer.gov/pro-ctcae/instrument-pro.html (aufgerufen am 17.04.2024).
Das Instrument, das primär zur Verwendung innerhalb klinischer Studien geschaffen wurde, lässt sich auch im Rahmen der regulären Patientenversorgung nutzen. Der PRO-CTCAE-Fragenpool für Erwachsene umfasst 124 Fragen (Items) zu 78 Symptomen, über die sinnvoll aus Patientenperspektive berichtet werden kann.
Die Patienten werden gebeten, für die Fragen die Antwort auszuwählen, die ihre Erfahrung in den letzten sieben Tagen am besten beschreibt. Bei Fragen zum Ausprägungsgrad stehen „Gar nicht“, „Ein wenig“, „Mäßig“, „Ziemlich“ oder „Sehr“ zur Wahl. Bei Fragen zur Häufigkeit „Nie“, „Selten“, „Gelegentlich“, „Häufig“ oder „Fast immer“. Einige Fragen sind mit „Ja“ und „Nein“ beantwortbar, andere mit „Möchte nicht antworten“ oder „Trifft nicht auf mich zu“.
Den Patienten wird je nach Toxizitätsprofil der Therapie lediglich eine Auswahl der Fragen vorgelegt. Die Vorauswahl relevanter Fragen kann mit einen Form Builder online zusammengestellt (https://healthcaredelivery.cancer.gov/pro-ctcae/builder.html, aufgerufen am 17.04.2024) und lokal abgespeichert werden. Unabhängig von der Fragenvorauswahl werden automatisch zusätzlich 5 freie Zeilen eingefügt, in die der Patient nach Bedarf weitere Nebenwirkungen oder Symptome eintragen und bewerten kann.
21.4 Patiententagebuch und mehr als App
Smarte mobile Endgeräte sind für die meisten Patientinnen und Patienten allzeitige Begleiter. Einige von ihnen könnten davon profitieren, diese Geräte auch zur Erfassung und Dokumentation der Nebenwirkungen zu nutzen.
Als Beispiel sei MIKA (Mein interaktiver Krebs Assistent) genannt. Die Mika-App begleitet Krebspatienten mit einem eigens entwickelten Unterstützungsprogramm, das personalisiert auf die Situation des Patienten angepasst wird.
Über die Mika-App führen Krebspatienten ihr digitales Tagebuch zu z.B. Therapieverlauf, Gesundheitszustand, Nebenwirkungen, allgemeines Wohlbefinden etc. Mit Hilfe der App kann sich der Patient zudem besser auf seinen nächsten Arzttermin vorbereiten.
Die Mika-App ist ein Medizinprodukt nach dem deutschem Medizinproduktegesetz. Sie wurde mit Ärzten entwickelt und von namhaften Onkologen und Psychoonkologen geprüft.
https://www.mitmika.de (aufgerufen am 13.06.2024)

